题目内容
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将CO2和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g)+H2(g)![]() CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+H2O(g) △H1=+41kJ/mol
CO(g)+2 H2(g)![]() CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
则由CO2和H2转化为甲醇蒸气和水蒸气的热化学方程式为____________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g)+3H(g)2![]() CH3OH(g)+H2O(g) △H3<0.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H3<0.测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
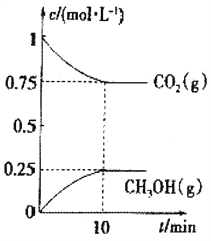
①能说明该反应已达平衡状态的是______________。
A.单位时间内有n molH—H键断裂,同时又n mol O—H键生成
B.混合气体的密度不随时间变化
C.体系中n(CO2)/n(H2)=1∶1,且保持不变
D.CO2的体积分数在混合气体中保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是__________。
A.升高温度
B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂
D.恒温恒容充入He(g)
③计算该温度下此反应的平衡常数K=__________(L/mol)2(保留3位有效数字);若使K的值变为1,则应采取的措施是___________。
A.增大压强 B.恒压加入一定量H2
C.升高温度 D.降低温度
(3)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1mol/LNa2CO3溶液完全捕捉224mL(己换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液显_________性(填酸,碱,中):且c(HCO3-)+c(CO32-)+c(H2CO3)=__________mol/L(填数字)。
【答案】 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ/mol CD B 0.198 D 碱 0.2
CH3OH(g)+H2O(g) △H=-49 kJ/mol CD B 0.198 D 碱 0.2
【解析】(1)①CO2(g)+H2(g)![]() CO(g)+H2O(g)△H1=+41kJ/mol,
CO(g)+H2O(g)△H1=+41kJ/mol,
②CO(g)+2 H2(g)![]() CH3OH(g)△H2=-90kJ/mol,根据盖斯定律,将①+②得:CO2(g)+3H2(g)
CH3OH(g)△H2=-90kJ/mol,根据盖斯定律,将①+②得:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ/mol,故答案为:CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H=-49 kJ/mol,故答案为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49 kJ/mol;
CH3OH(g)+H2O(g) △H=-49 kJ/mol;
(2)①A.单位时间内有nmolH-H键断裂,同时有nmolO-H键生成,均体现正反应速率,不能判定平衡,故A不选;B.气体的质量、体积始终不变,混合气体的密度不随时间变化,不能判定平衡,故B不选;C.反应物的起始量不同,体系中n(CO2)/n(H2)=1:1,且保持不变,符合特征“定”,为平衡状态,故C选;D.CO2的体积分数在混合气体中保持不变,符合特征“定”,为平衡状态,故D选;故答案为:CD;
②能使n(CH3OH)/n(CO2)增大,平衡正向移动,且不能增加n(CO2)。A.该反应为放热反应,升高温度,平衡逆向移动,故A不选;B.恒温恒容下,再充入2molCO2、3molH2,相当于体积减小一半,压强增大,平衡正向移动,使n(CH3OH)/n(CO2)增大,故B选;C.使用高效催化剂,平衡不移动,故C不选;D.恒温恒容充入He(g),平衡不移动,故D不选;故答案为:B;
③结合起始量及图象可知,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
开始 1 1.5 0 0
转化0.25 0.75 0.25 0.25
平衡 0.75 0.750.25 0.25
K=![]() =
=![]() ≈0.198<1,若使K的值变为1,应使平衡正向移动,且K与温度有关,该反应为放热反应,则只有降低温度,故答案为:0.198;D;
≈0.198<1,若使K的值变为1,应使平衡正向移动,且K与温度有关,该反应为放热反应,则只有降低温度,故答案为:0.198;D;
(3)100mL0.1mol/LNa2CO3的溶液中溶质的物质的量为0.1L×0.1mol/L=0.01mol,224mLCO2的物质的量为![]() =0.01mol,发生反应Na2CO3+CO2+H
=0.01mol,发生反应Na2CO3+CO2+H![]() =0.2mol/L,故答案为:碱;0.2。
=0.2mol/L,故答案为:碱;0.2。

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案