题目内容
如图是甲醇/过氧化氢燃料电池内部结构示意图。 工作时,甲醇和过氧化氢分别进入燃料电池的燃料腔和氧化剂腔,在各自催化剂的作用下发生反应,并向外界输出电能。下列说法不正确的是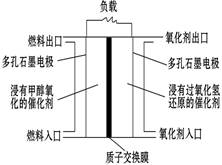
| A.该电池的正极反应式:H2O2+2H++2e—=2H2O |
| B.燃料腔中的多孔石墨电极为该燃料电池的负极,负极产生的H+通过质子交换膜流向正极 |
| C.电池工作时,1 mol甲醇被氧化有6 mol电子转移 |
| D.电路中的电子经正极、负极、质子交换膜后再回到正极,形成闭合回路 |
D
解析试题分析:根据题给装置图分析,通入甲醇的电极为原电池的负极,发生氧化反应,电极反应式为CH3OH-6e-+H2O=CO2+6H+,加入H2O2的电极为原电池的正极,发生还原反应,电极反应式为H2O2+2H++2e-=2H2O。A、加入H2O2的电极为原电池的正极,发生还原反应,电极反应式为H2O2+2H++2e-=2H2O,正确;B、原电池中阳离子移向正极,故负极产生的H+ 通过质子交换膜流向正极,正确;C、负极电极方程式为CH3OH-6e-+H2O=CO2+6H+,电池工作时,1mol甲醇被氧化有6mol电子转移,正确;D、电路中的电子经负极经外电路流向正极,电子不能经过电解质溶液,错误。
考点:考查原电池原理、化学电源。

练习册系列答案
相关题目
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-==2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置 |
将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是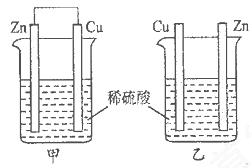
| A.两烧杯中铜片表面均无气泡产生 | B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的酸性均减弱 | D.产生气泡的速率甲比乙慢 |
锌溴液流电池是一种新型电化学储能装置(如右图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法不正确的是
| A.充电时电极a连接电源的负极 |
| B.放电时负极的电极反应式为Zn—2e-=Zn2+ |
| C.放电时左侧电解质储罐中的离子总浓度增大 |
| D.阳离子交换膜可阻止Br2与Zn直接发生反应 |
下图就是一个用废旧材料制作的可用于驱动玩具的电池的示意图。当电池工作时,下列有关说法正确的是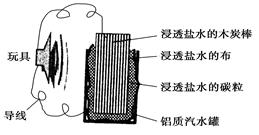
| A.电池的能量转化率可达100% |
| B.铝罐是电池的负极 |
| C.炭棒应与玩具电机的负极相连 |
| D.电池工作一段时间后炭棒和碳粒的质量会减轻 |
用Zn片、Cu片和稀硫酸组成的电池装置。下列有关该装置的说法不正确的是( )
| A.该装置将化学能转变为电能 | B.溶液中的阳离子向锌电极移动 |
| C.Cu极上有气泡产生,发生还原反应 | D.电流方向是从铜片流向锌片 |
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( ) 
| A.a为负极,b为正极 |
| B.若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析出 |
| C.若a、b极都是石墨,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等 |
| D.若电解精炼粗铜时,b极是粗铜,a极是纯铜 |
某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO)3 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 |
