题目内容
已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图(Ⅰ)所示:ΔH1=ΔH2+ΔH3;根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是
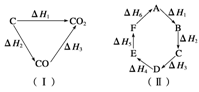

| A.A―→F ΔH=-ΔH6 |
| B.A―→D ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 |
| D.ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5 |
D
根据盖斯定律可知只要反应物和生成物确定无论经过怎样的途径反应热都相等,如果反应物和生成物互换那么反应热互为相反数,所以A、B、C正确。D错误,可改为-(ΔH1+ ΔH6)=ΔH2+ΔH3+ΔH4+ΔH5

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是( )

 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
 稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( ) )+
)+ H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol
H2 SO4(aq)=K2SO4(aq)+H2O(l);ΔH=-57.3kJ/mol