题目内容
(15分)
(1)已知:2SO2(g)+ O2 (g) 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-1
2NO(g)+ O2 (g) 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1
则反应NO2(g)+ SO2 (g) SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1
一定条件下,将NO2与SO2按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g) CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
选择此压强的理由是 ________。
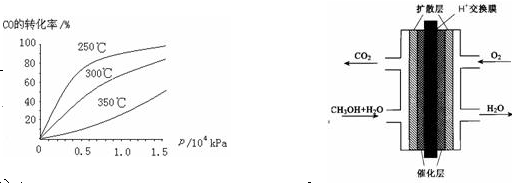
(3)甲醇(CH3OH)燃料电池的结构示意图如右上。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(4)101 kPa时,若16 gCH3OH完全燃烧生成液态水,放出热量
为363.25 kJ/mol,则甲醇燃烧的热化学方程式为 。
(1)已知:2SO2(g)+ O2 (g)
 2SO3 (g) △H =-196.6kJ·mol-1
2SO3 (g) △H =-196.6kJ·mol-12NO(g)+ O2 (g)
 2NO2 (g) △H =-113.0kJ·mol-1
2NO2 (g) △H =-113.0kJ·mol-1则反应NO2(g)+ SO2 (g)
 SO3 (g) +NO(g)的△H =______kJ·mol-1
SO3 (g) +NO(g)的△H =______kJ·mol-1一定条件下,将NO2与SO2按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1molSO3的同时生成1molNO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+ 2H2 (g)
 CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,
CH3OH (g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H _____0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 ________。

(3)甲醇(CH3OH)燃料电池的结构示意图如右上。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(4)101 kPa时,若16 gCH3OH完全燃烧生成液态水,放出热量
为363.25 kJ/mol,则甲醇燃烧的热化学方程式为 。
(1)-41.8;b;(各2分)
(2)<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失(各2分)
(3)负 O2 + 4H+ + 4e-="==" 2H2O (各2分)
(4)CH3OH(l) + 3/2 O2(g) ="==" CO2(g) + 2H2O(l) △H ="-726.5" kJ/mol(3分)
(2)<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失(各2分)
(3)负 O2 + 4H+ + 4e-="==" 2H2O (各2分)
(4)CH3OH(l) + 3/2 O2(g) ="==" CO2(g) + 2H2O(l) △H ="-726.5" kJ/mol(3分)
略

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 TiCl4+2CO
TiCl4+2CO H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因 (用适当化学方程式辅以必要的文字说明)。 Mg+Cl2 TiCl4+2Mg
Mg+Cl2 TiCl4+2Mg  ,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。
,使用时先充电,写出其充电式的阳极反应 ,放电时Li+的移动方向 。
 C(金刚石,s) △H>0,则石墨比金刚石稳定
C(金刚石,s) △H>0,则石墨比金刚石稳定
 O2(g)
O2(g) ZnO(s);ΔH="-351.5" kJ·mol-1
ZnO(s);ΔH="-351.5" kJ·mol-1 ="-90.84" kJ·mol-1
="-90.84" kJ·mol-1