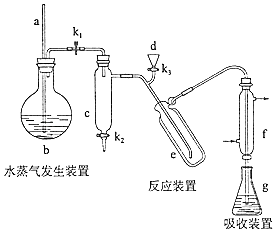
题目内容
【题目】如图1,溶液A中可能含有Mg2+、Cu2+、Al3+、Fe2+四种阳离子,B为淡黄色固体,旋开E后,有气体放出和白色沉淀生成,淡黄色固体的物质的量与产生沉淀的质量关系如图2. 
(1)则溶液中含有的阳离子有 .
(2)写出图2曲线a~b段反应的离子方程式 , .
(3)A溶液中存在的阳离子的物质的量浓度之比为 .
【答案】
(1)Mg2+、Al3+
(2)2Na2O2+2H2O═4Na++4OH﹣+O2↑;Al(OH)3+OH﹣=AlO2﹣+2H2O
(3)1:2
【解析】解:(1)若溶液中有Cu2+会生成蓝色沉淀,有Fe3+会生成红褐色沉淀,题中只有白色沉淀,而且由图可知白色沉淀能部分溶于氢氧化钠,可知沉淀为氢氧化镁和氢氧化铝,所以溶液中的离子为:Mg2+、Al3+.所以答案是:Mg2+、Al3+;(2)横坐标为4﹣5moL时,发生的化学反应是:Na2O2先与水反应:2Na2O2+2H2O═4Na++4OH﹣+O2↑,生成的NaOH将Al(OH)3溶解:Al(OH)3+OH﹣=AlO2﹣+2H2O,
所以答案是:2Na2O2+2H2O═4Na++4OH﹣+O2↑;Al(OH)3+OH﹣=AlO2﹣+2H2O;(3)Al(OH)3完全溶解消耗消耗1moL过氧化钠即2molNaOH,由方程式可知n[Al(OH)3]=n(NaOH)=2mol,根据铝元素守恒可知,n(Al3+)=n[Al(OH)3]=2mol;
横坐标为0﹣4moL时发生的化学反应是:Mg2++2OH﹣=Mg(OH)2↓、Al3++3OH﹣=Al(OH)3↓沉淀为最大值时,该阶段消耗4mol过氧化钠即8molNaOH,根据OH﹣守恒,2n[Mg(OH)2]+3n[Al(OH)3]=n(NaOH),Mg2+物质的量为1mol,故Mg2+、Al3+的物质的量浓度之比为1:2,所以答案是:1:2.

【题目】只给出表中甲和乙对应的量,不能用来求物质的量的是
甲 | 乙 | |
① | 物质微粒数 | 阿伏加德罗常数 |
② | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
③ | 固体体积 | 固体密度 |
④ | 溶液质量分数 | 溶液体积 |
⑤ | 非标准状况下物质的质量 | 物质的摩尔质量 |
A. ②③④ B. ③④⑤ C. ③④ D. ④