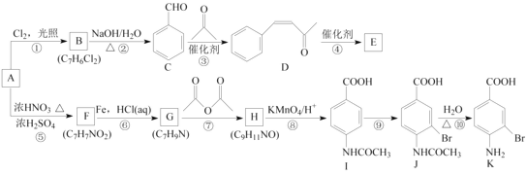
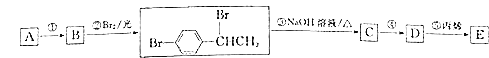题目内容
【题目】铁及铁的化合物在生活、生产中具有广泛应用,如亚铁氰化钾即K4[Fe(CN)6]是食盐中常用的抗结剂、铁基(氟掺杂镨氧铁砷化合物)是高温超导材料、“愚人金”是制备硫酸的主要矿物原料。请按要求回答下列问题。
(1)K4[Fe(CN)6]配合物中存在的作用力类型有__________________________(从“金属键”、“离子键”、“共价键”、“配位键”、“氢键”、“范德华力”中选填);其中CN-中各原子最外层均满足8电子稳定结构,其电子式为_____________,其中C原子的杂化形式是_________。
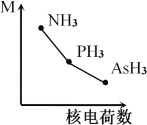
(2)铁基化合物中氟、氧、砷三种元素中电负性值由大到小的顺序是_____________(填元素符号)。其中氢化物(RH3)的某种性能(M)随R的核电荷数的变化趋势如图所示,则纵轴M可能表示为_____________________(从“沸点”、“稳定性”、“分子间作用力”、“R—H键能”中选填)。
(3)FeCl3晶体熔点为306℃,而FeF3晶体熔点高于1000℃,试解释两种化合物熔点差异较大的原因:____________________________________________。
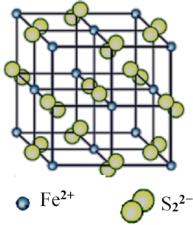
(4)“愚人金”是铁硫化合物,其晶体的晶胞如图所示。该晶体的化学式______________。
【答案】离子键、共价键、配位键 [:C![]() N:]- sp杂化 F>O>As 稳定性、R—H键能 F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体 FeS2
N:]- sp杂化 F>O>As 稳定性、R—H键能 F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体 FeS2
【解析】
(1)根据配合物分析作用力;因CN-各原子均满足8电子稳定结构,据此写电子式;根据VSEPR模型计算C原子的杂化类型;
(2)原子的电负性同一周期从左到右依次增大、同一主族从上到下依次减小;同一主族,从上到下非金属逐渐减弱;
(3)F的电负性较强,FeCl3为分子晶体,微粒之间的作用力是分子间作用力,FeF3位离子键晶体,微粒之间的作用力是离子键;
(4)从晶体结构,顶点乘以八分之一、边上乘以四分之一、面心乘以二分之一、体心乘以一,进行计算。
(1)配合物中主要含有离子键、共价键、配位键;因CN-各原子均满足8电子稳定结构,故CN-的电子式为[:C![]() N:]-;CN一中碳原子的价层电子数为:
N:]-;CN一中碳原子的价层电子数为:![]() ,所以碳原子的杂化轨道类型是sp杂化,故答案为:离子键、共价键、配位键;[:C
,所以碳原子的杂化轨道类型是sp杂化,故答案为:离子键、共价键、配位键;[:C![]() N:]-;sp杂化;
N:]-;sp杂化;
(2)原子的电负性同一周期从左到右依次增大、同一主族从上到下依次减小,故F、O、As的电负性从大到小为F>O>As;因N、P、As三者的非金属性一次减弱,故M可能是稳定性或者R-H键能,故答案为:F>O>As;稳定性、R—H键能;
(3)F的电负性较强,FeCl3为分子晶体,微粒之间的作用力是分子间作用力,FeF3为离子键晶体,微粒之间的作用力是离子键,故FeF3的熔点较高,故答案为:F比Cl的电负性大,FeF3为离子晶体,FeCl3为分子晶体;
(4)从晶体结构中可以看出,Fe2+分布在8个定点和6个面心,故晶胞中含有![]() =4个Fe2+,S22-分布在12条棱和体心上,故晶胞中含有
=4个Fe2+,S22-分布在12条棱和体心上,故晶胞中含有![]() =4个S22-,则分子式为FeS2,故答案为:FeS2。
=4个S22-,则分子式为FeS2,故答案为:FeS2。

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作、现象和结论均正确的是
操作 | 可能的实验现象 | 解释 | |
A | 用硫酸做催化剂的淀粉水解液中,加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 葡萄糖含醛基 |
B | 向酚酞溶液中加入足量Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将已氧化的Cu丝从酒精灯的外焰慢慢移向内焰 | 黑色的Cu丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:Na2CO3>NaHCO3 |
A.AB.BC.CD.D