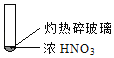题目内容
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____________________ 。
(2)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中,P元素的化合价为 _____________。
②NaH2PO2为________(填 “正盐”或“酸式盐”),其溶液显______(填“弱酸性”、 “中性”或“弱碱性”)。
③利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产 物为_____(填化学式)。
【答案】H3PO2![]() H++ H2PO2—+1正盐弱碱性PO43—
H++ H2PO2—+1正盐弱碱性PO43—
【解析】
(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为:H3PO2![]() H++ H2PO2—,故答案为:H3PO2
H++ H2PO2—,故答案为:H3PO2![]() H++ H2PO2—;
H++ H2PO2—;
(2)①由化合物中正负化合价的代数和为零可知H3PO2中,P元素的化合价为+1价,故答案为:+1;②因H3PO2是一元中强酸,故NaH2PO为正盐,属于强碱弱酸盐,由盐类水解可知其水溶液显碱性,故答案为:正盐、弱碱性;③该反应中Ag+为氧化剂,H3PO2为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,4×(1-0)=1×(x-1),解得x=5,所以氧化产物为+5价的H3PO4,故答案为:PO43—(或H3PO4)。

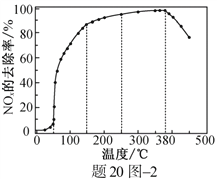
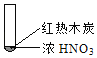
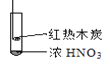
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体能表明②中木炭与浓硝酸发生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,不一定说明木炭与浓硝酸发生了反应