��Ŀ����
����Ŀ��KMnO4��һ�ֵ��͵�ǿ�����������������գ�
������KMnO4������Һ����Cu2S��CuS�Ļ����ʱ�������ķ�Ӧ���£�
�� MnO4��+ Cu2S + H+�� Cu2+ + SO2�� + Mn2+ + H2O (δ��ƽ)
�� MnO4��+ CuS + H+ �� Cu2+ + SO2�� + Mn2+�� H2O (δ��ƽ)
��1�����й��ڷ�Ӧ�ٵ�˵���д������_________��ѡ���ţ���
a����������Ԫ����Cu��S b���������뻹ԭ�������ʵ���֮��Ϊ8:5
c����ԭ�Ե�ǿ����ϵ�ǣ� Mn2+<Cu2S d��ÿ����2.24 L(���) SO2��ת��0.6mol����
��2����ƽ�������Ӧ���е���ת�Ƶķ������Ŀ��_____
MnO4��+ CuS + H+ �� Cu2+ + SO2�� + Mn2+�� H2O
��3������H2O2����KMnO4�з�Ӧ��2KMnO4+7H2O2+3H2SO4= K2SO4+2MnSO4+6O2��+10H2O����1molKMnO4������H2O2��_________mol��
II����֪�ڼ��������£�MnO4����e������MnO42�� (��ɫ)
��4�� ��KMnO4��Һ����NaOH��Һ���ȣ��õ�������ɫ��Һ���������������ɣ�д����Ӧ�����ӷ���ʽ_____________��
���𰸡� d ![]() +28 H+ == 5Cu2+ + 5SO2�� + 6Mn2+��14H2O 2.5 4MnO4-��4OH-= 4MnO42-��O2���� 2H2O
+28 H+ == 5Cu2+ + 5SO2�� + 6Mn2+��14H2O 2.5 4MnO4-��4OH-= 4MnO42-��O2���� 2H2O
����������1��a����Ӧ��ͭԪ�ء���Ԫ�ػ��ϼ����ߣ���������Ԫ����Cu��S��a��ȷ��b��1mol������صõ�5mol���ӣ�1mol Cu2Sʧȥ8mol���ӣ���˸��ݵ��ӵ�ʧ�غ��֪�������뻹ԭ�������ʵ���֮��Ϊ8:5��b��ȷ��c����ԭ���Ļ�ԭ��ǿ�ڻ�ԭ����Ļ�ԭ�ԣ���ԭ�Ե�ǿ����ϵ�ǣ�Mn2+<Cu2S��c��ȷ��d��ÿ����2.24 L(���)SO2����0.1mol SO2����0.1molCu2S�����ת��0.8mol������d����ѡd����2����Ӧ��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�ۣ��õ�5�����ӡ�SԪ�ػ��ϼ۴ӣ�2�����ߵ�+4�ۣ�ʧȥ6�����ӣ����Ը��ݵ��ӵ�ʧ�غ��֪����ת�Ƶķ������ĿΪ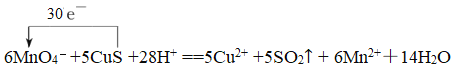 ����3����Ӧ��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�ۣ��õ�5�����ӣ�1molKMnO4�õ�5mol���ӣ�˫��ˮ����Ԫ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ�1mol˫��ˮʧȥ2mol���ӣ����Ա�1molKMnO4������H2O2��5mol��2��2.5mol����4����KMnO4��Һ����NaOH��Һ���ȣ��õ�������ɫ��Һ��˵����ԭ������MnO42�����������������ɣ���˻����������ɣ���Ӧ�����ӷ���ʽΪ4MnO4-��4OH-=4MnO42-��O2����2H2O��
����3����Ӧ��MnԪ�ػ��ϼ۴�+7�۽��͵�+2�ۣ��õ�5�����ӣ�1molKMnO4�õ�5mol���ӣ�˫��ˮ����Ԫ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ�1mol˫��ˮʧȥ2mol���ӣ����Ա�1molKMnO4������H2O2��5mol��2��2.5mol����4����KMnO4��Һ����NaOH��Һ���ȣ��õ�������ɫ��Һ��˵����ԭ������MnO42�����������������ɣ���˻����������ɣ���Ӧ�����ӷ���ʽΪ4MnO4-��4OH-=4MnO42-��O2����2H2O��

����Ŀ���о�ͭ���仯��������ʶԿ��С�������������Ҫ�����壮
��1��ͭ�ɲ������·����Ʊ�
�ٻ���ͭ��Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
��ʪ����ͭ��CuSO4+Fe�TFeSO4+Cu
�������ַ����У�ͭԪ�ؾ��� �����������ԭ������ͭ���ʣ����âٷ�ÿ�Ƶ�32gCu��ת�Ƶ��ӵ����ʵ����� ��
��2���ڳ�ʪ�Ŀ�����ͭ���Է����绯ѧ��ʴ������ͭ�̣�ͭ�̵Ļ�ѧʽΪ ������ʴ��������ӦʽΪ�� ����ͭ��п��ɵĻ�ͭ�Ͻ������⣬�����ʴ�ķ����� ��
��3����Li����CuO����ܷ�ӦΪ��2Li+CuO�TLi2O+Cu���������ҺΪ��������л���Һ����ص�������ӦʽΪ�� ����
��Cu2O��һ�ְ뵼����ϣ����ڼ�����Һ���õ�ⷨ��ȡ������ܷ�ӦʽΪ��
2Cu+H2O![]() Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
��4��Ϊ�˻��մ�ͭ�������������е�Ag��Au��ijʵ��С��������й��������±���
��� | �����·�Ӧ | ��ѧƽ�ⳣ�� |
��Ӧ�� | Au+6HNO3Au��NO3��3+3NO2��+3H2O | ��10��5 |
��Ӧ�� | Au3++4Cl��[AuCl4]�� | ��105 |
�������п�֪�������½���������ᷴӦ����ȴ��������ˮ��Ũ������Ũ���������Ϊl��3�Ļ������������û�ѧƽ���ƶ�ԭ������Ҫ˵������������ˮ��ԭ�� ��
