��Ŀ����
����Ŀ����֪�������������ϳɰ���ӦΪ��N2��g��+3H2��g���T2NH3��g����H=��92kJmol��1��ش��������⣺
��1��ȡ1mol N2��g����3molH2��g������һ�ܱ������У�һ�������½��з�Ӧ����ƽ��ʱ����÷�Ӧ�ų�������92kJ������ڡ��������ڡ���С�ڡ�����ԭ�������������¶ȣ�������Ӧ�С�H����������С�����䡱����
��2����֪���ֱ��ƻ�1molN��H����1mol H��H����Ҫ���յ�����Ϊ��391kJ��436kJ�����ƻ�1mol N��N����Ҫ���յ�����Ϊ ��
��3��һ�������£������Ϊ2L�ĺ����ܱ������г���1molNH3��g�� ������������Ӧ������Ӻ�Ӧ�ﵽƽ�⣬���v��NH3��=0.40mol/��Lmin�����������ϳɰ���Ӧ��ƽ�ⳣ��Ϊ ��
��4�������������Ϊ1L�ĺ����ܱ������зֱ����1molN2��3molH2 �� ���ֱ�ֻ�ı�����һ���������ʱʹ��Ӧ�ﵽƽ�⣬��ð������������ʱ��ı仯��ͼ��ʾ�� 
����ͼ���У�ֻ�ı��¶ȵ�Ϊ���I����II����III������ͬ����ֻ�ı�ѹǿ��Ϊ �� ֻ�ı������Ϊ ��
��5�����ѱ�״����8.96L����ͨ�뵽100g9.8%��������Һ�в���ȫ���գ�������Һ������Ũ�ȴӴ�С��˳���� ��
��6�������£���Ũ�Ⱦ�Ϊ0.1mol/L��MgCl2��FeCl3��AlCl3�����Һ��ͨ��NH3���������������ɳ����Ļ�ѧʽΪ �� ��pH=ʱ����ʼ����Mg��OH��2������ ����֪��Ksp[Mg��OH��2]=1.0��10��13�� Ksp[Fe��OH��3]=1.0��10��40��Ksp[Al��OH��3]=1.0��10��33��
���𰸡�
��1��С�ڣ������ǿ��淴Ӧ��1mol N2 ��3mol H2 �����ܱ������в�������ȫת��Ϊ2mol�İ��������Էų�����һ��С��92.0 kJ������
��2��946 kJ/mol
��3��![]()
��4����
��5��c��NH+����c��SO42������c��OH������c��H+��
��6��Fe��OH��3��6
���������⣺��1��N2 ��H2��Ӧ����2mol NH3ʱ�ų�������Ϊ92.0kJ����ָ1mol������1mol��������ȫ��Ӧ����2mol�İ����ų�������Ϊ92.0kJ��1mol N2 ��3mol H2 �����ܱ������в�������ȫת��Ϊ���������Էų�����һ��С��92.0 kJ����Ӧ�ȡ�H�����ʵĻ�ѧ�������йأ����ʵĻ�ѧ���������䣬�Ȼ�ѧ����ʽ�з�Ӧ�Ȳ��䣬���Դ��ǣ�С�ڣ������ǿ��淴Ӧ��1mol N2 ��3mol H2 �����ܱ������в�������ȫת��Ϊ2mol�İ��������Էų�����һ��С��92.0 kJ�����䣻��2����N��N�ļ���Ϊx��
���ڷ�ӦN2��g��+3H2��g��=2NH3��g����H=��92.0kJ/mol��
��Ӧ��=��Ӧ����ܼ��ܩ���������ܼ��ܣ���x+3��436kJ/mol��2��3��391kJ/mol=��92.0kJ/mol
��ã�x=946 kJ/mol��
���Դ��ǣ�946 kJ/mol��
����3��ƽ��ʱ��
2NH3��g�� | N2��g��+ | 3H2��g�� | ||
��ʼ��mol/L�� | 0.5 | 0 | 0 | |
ת����mol/L�� | 0.5��0.40 | 0.1 | 0.3 | |
ƽ�⣨mol/L�� | 0.3 | 0.1 | 0.3 |
K= ![]() =
= ![]() ��
��
�������ϳɰ���Ӧ��ƽ�ⳣ��K= ![]() =
= ![]()
���Դ��ǣ� ![]() ��4��ͼ����Ǹı��¶ȣ����·�Ӧ���ʼӿ죬�ﵽƽ��ʱ��̣���Ӧ���ȣ�ƽ�������ƶ�����T2��T1��
��4��ͼ����Ǹı��¶ȣ����·�Ӧ���ʼӿ죬�ﵽƽ��ʱ��̣���Ӧ���ȣ�ƽ�������ƶ�����T2��T1��
ͼ����ǼӴ���������ֻ�ı䷴Ӧ���ʣ�ƽ��״̬���ı䣻
ͼ���ı�ѹǿ������ѹǿ��Ӧ���ʼӿ죬ƽ�������ƶ�����P1��P2 ��
���Դ��ǣ���5����״����8.96L������0.4mol����ͨ�뵽100g9.8%��������Һ��0.1mol��������Һ�У�����0.1mol��NH4��2SO4 �� ����0.2molNH3H2O������c��NH+�����c��H+����С��������Һ������Ũ�ȴӴ�С��˳����c��NH+����c��SO42������c��OH������c��H+����
���Դ��ǣ�c��NH+����c��SO42������c��OH������c��H+������6������Al��OH��3��Mg��OH��2��Fe��OH��3���ܶȻ���������25���£���Ũ�Ⱦ�Ϊ0.1molL��1��AlCl3��MgCl2��FeCl3�����Һ��ͨ��NH3���������������ӿ�ʼ����ʱ��OH��Ũ�ȷֱ��ǣ� ![]() =1.0��10��13��
=1.0��10��13�� ![]() =2.15��10��11��
=2.15��10��11�� ![]() =1.0��10��6 �� ������ͬ��Ũ�ȵİ�ˮ��Fe��OH��3����������pH=��lg��1.0��10��6��=6���ʵ�pH=6ʱ����ʼ����Mg��OH��2������
=1.0��10��6 �� ������ͬ��Ũ�ȵİ�ˮ��Fe��OH��3����������pH=��lg��1.0��10��6��=6���ʵ�pH=6ʱ����ʼ����Mg��OH��2������
���Դ��ǣ�Fe��OH��3��6��
�����㾫����������Ĺؼ��������ⷴӦ�Ⱥ��ʱ�����֪ʶ�������ڻ�ѧ��Ӧ�зų������յ�������ͨ���з�Ӧ�ȣ��Լ��Ի�ѧƽ��ļ�������⣬�˽ⷴӦ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��

����Ŀ����ú�ң���Ҫ����SiO2��Fe2O3��Al2O3�ȣ���ȼú��������в����ķ�������ú�ҵ��ۺ����þ��кܴ�ļ�ֵ��
���о���Աͨ��ʵ��Է�ú����������Ԫ�صķ��빤�ս������о���
��1����������Һ�ֽ��ú�ң�ʹ���е�������Ԫ���ܳ�������ʵ�ֳ������룮
��д��������Һ��Fe2O3��Ӧ�����ӷ���ʽ ��
�ڳ�������õ���������Ҫ�ɷ��� ��
��2����1���������õ���Һ�м��뻹ԭ��ʹFe3+ת��ΪFe2+ �� ��ϱ�������ԭ�� ��
���� | Fe��OH��2 | Fe��OH��3 | Al��OH��3 |
�������䣨pH�� | 7.06��8.95 | 1.94��3.20 | 3.69��4.8 |
��3��ʹ�ü��Խ����İ�ˮΪpH���ڼ������з���ʵ�飮
�ٰ�ˮʹ��Һ�������ӳ��������ӷ���ʽΪ ��
�ڷ�Ӧ�յ��pH������������Ч����Ӱ����ͼ1������ʵ������Ϊ�ﵽ�õķ���Ч������Ӧ�����п���pH�ķ�Χ�� �� ѡ��÷�Χ�������� �� 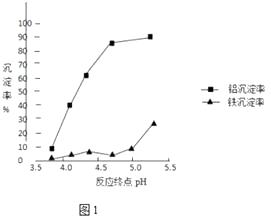
��4����NH4HSO4��H2SO4�����ʵ�����1��1������Ƴɽ�ȡҺ��220��ʱ���ɽ�������ú����Al2O3ת��Ϊ�������[NH4Al��SO4��2]��Ȼ����롢���ջ�ô�Al2O3 ��
��֪������泥����ܽ�ȣ�0��ʱ��S=5.2g��100��ʱ��S=421.9g��
��280��ʱ�ֽ⣮
�������Ͽ�֪��������������������ʷ���ķ����� ��
��5������NH4Al��SO4��2ͬʱ�õ�������壨NH3��N2��SO2��SO3��H2O������16mol������尴ͼ2װ�ñ���ȫ�����Ƶý�ȡҺ���뽫ͼ2���Լ��������ʵ�������������




