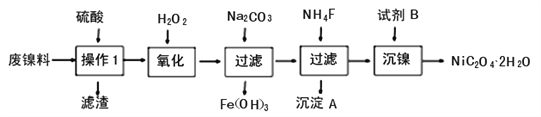
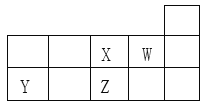
题目内容
【题目】烟气中SO2和NOx(NO及NO2)的脱除对于环境保护意义重大。
(1)湿式氨法烟气脱硫脱氮是通过氨水吸收烟气,得到含NH4+、SO32-、SO42-、HSO3-、和NO2-的吸收液。
① 用离子方程式解释吸收液中含有SO32-的原因:_______________。
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2反应生成NO2-的离子方程式是_______________________。
b. 经测定,在烟气的吸收过程中,吸收液对NO2的吸收率随烟气通入量变化的曲线如下图所示。

结合化学用语解释产生上述结果的原因:_____________。
(2)二氧化氯(ClO2)具有很强的氧化性,可用于烟气中SO2和NO的脱除。
① 酸性条件下,电解NaClO3溶液,生成ClO2的电极反应式是__________。
② 研究表明:ClO2氧化SO2和NO的反应历程与下列反应有关。
i.NO + ClO2 === NO2+ ClO
ii.NO + ClO === NO2 + Cl
iii.SO2 + ClO2 === SO3+ ClO
iv.SO2 + ClO === SO3 + Cl
实验测得:ClO2分别氧化纯SO2和纯NO的氧化率以及ClO2氧化SO2和NO混合气中的SO2氧化率随时间的变化情况如下图所示。

a. 结合上述信息,下列推论合理的是________(填字母序号)。
A. NO的存在会影响ClO2氧化SO2的反应速率
B. ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的NO2可以加快ClO2氧化SO2的反应速率
b. 结合反应历程,分析混合气中SO2氧化速率较纯SO2氧化速率快的可能原因是_____。
【答案】 SO2 + 2NH3·H2O === SO32- + 2NH4+ + H2O 2NO2 + SO32- + 2OH- === 2NO2- + SO42- + H2O SO2 + SO32- + H2O === 2HSO3-,随着烟气通入量的增加,吸收液中c(HSO3-)增大,c(SO32-)减小,导致吸收液对NO2的吸收能力下降 ClO3- + 2H+ + e- === ClO2 + H2O AB 因ClO2氧化NO的反应速率较快,故当SO2中混有NO时,ClO2氧化NO生成的ClO会继续氧化SO2,即随ClO浓度的增加,氧化混合气中SO2的氧化速率增大
【解析】试题分析:(1)①SO2与氨水反应生成亚硫酸铵。
② 吸收液中的SO32-、HSO3-均对NO2具有吸收作用,但HSO3-对NO2的吸收能力比SO32-弱。
a. SO32-与NO2发生氧化还原反应生成NO2-和SO42-。
b. 随着烟气通入量的增加,吸收液中c(HSO3-)增大,c(SO32-)减小。
(2)① 酸性条件下,电解ClO3-在阴极得电子发生还原反应生成ClO2。
②a A. 根据图示,混合气体中ClO2氧化SO2的反应速率加快
B. 根据图示,ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率
C. 反应i中生成的ClO可以加快氧化SO2的反应速率;
b. ClO2氧化NO的反应速率较快,故当SO2中混有NO时,ClO2氧化NO生成的 ClO会继续氧化SO2
解析:(1)①SO2与氨水反应生成亚硫酸铵,反应离子方程式为SO2 + 2NH3·H2O === SO32- + 2NH4+ + H2O。
②a. 根据氧化还原反应规律,SO32-与NO2发生氧化还原反应生成NO2-和SO42-,反应离子方程式为2NO2 + SO32- + 2OH- === 2NO2- + SO42- + H2O。
b. SO2 + SO32- + H2O === 2HSO3-,随着烟气通入量的增加,吸收液中c(HSO3-)增大,c(SO32-)减小,导致吸收液对NO2的吸收能力下降。
(2)① 酸性条件下,电解ClO3-在阴极得电子发生还原反应生成ClO2,阴极电极反应为ClO3- + 2H+ + e- === ClO2 + H2O。
② a.根据图示,混合气体中ClO2氧化SO2的反应速率加快,故A正确;根据图示,ClO2氧化SO2的反应速率慢于ClO2氧化NO的反应速率,故B正确 ;反应i中生成的ClO可以加快氧化SO2的反应速率,故C错误;
b. ClO2氧化NO的反应速率较快,故当SO2中混有NO时,ClO2氧化NO生成的 ClO会继续氧化SO2,即随ClO浓度的增加,氧化混合气中SO2的氧化速率增大

 阅读快车系列答案
阅读快车系列答案