题目内容
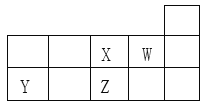
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
A. Y、Z、X三种元素的原子半径依次增大
B. X、Z都是第2周期VIA族元素,单质的氧化性X>Z
C. Y的气态氢化物的热稳定性比Z的高
D. R元素与W同族且相邻周期,则R元素最高价氧化物的水化物的酸性比Z的强
【答案】D
【解析】根据元素周期表中位置可知X为氧元素,W为氟元素,Y为硅元素,Z为硫元素。则A、同周期元素原子半径从左到右依次减小,同主族元素原子半径从上而下依次增大,故Y、Z、X三种元素的原子半径依次减小,选项A错误;B、 X、Z分别是第2周期VIA族元素和第3周期VIA族元素,单质的氧化性X>Z,选项B错误;C、SiH4的热稳定性比H2S的低,选项C错误;D、R元素与W同族且相邻周期,则R为氯元素,其最高价氧化物的水化物HClO4的酸性比H2SO4强,选项D正确。答案选D。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目