题目内容
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
【答案】B
【解析】试题分析:X、Y、Z、W均为短周期元素,即四种元素的原子序数不大于18,Y原子的最外层电子是内层电子数的3倍,内层只能是第一电子层,第一电子层有2个电子,第二电子层有6个电子,所以Y是O元素;X、Y属于同一周期且相邻,所以X是N元素;Y、Z属于同一主族,且Z在Y的下一周期,所以Z是S元素;W和Z是同一周期元素,且W、Z相邻,所以W是Cl元素。A.X和Y属于同一周期,Y的原子序数大于X的,Y的非金属性大于X的,所以Y的气态氢化物比X的稳定,A项错误;B.Z和W属于同一周期的元素,W的原子序数大于Z的,所以W的非金属性大于Z的,W的最高价氧化物的水化物的酸性大于Z的,B项正确;C.Y和Z属于同一主族的元素,Z的原子序数大于Y的,所以Y的非金属性比Z强,C项错误;D.X与Y形成的化合物有NO、NO2、N2O3等化合物,NO难溶于水,D项错误;答案选B。

【题目】钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________,基态S原子电子占据最高能级的电子云轮廓图为___________,其中Na2S4中存在的化学键有:___________。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________,空间构型是______________________。
(4)下表列出了钠的卤化物的熔点:
化学式 | NaF | NaCl | NaBr | NaI |
熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是_________________________________;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________pm;NaH的理论密度是___________g·cm-3(保留三位有效数字)。[H—1、Na—23]
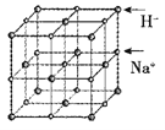
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶跑,则x=___________。