题目内容
【题目】有机物A蒸气的密度是相同条件下氢气密度的29倍,5.8 g A在氧气中完全燃烧生成13.2 g CO2和5.4 g H2O。
(1)请通过计算确定A的分子式_______。(写出计算过程)
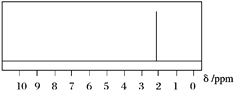
(2)已知A的1H核磁共振氢谱如下图所示,则A的结构简式为______________________。
(3)已知B、C都是A的同分异构体。
①若B可发生银镜反应,则此反应的化学方程式为__________________________________。
②若C无甲基且可与金属钠反应,则C的结构简式为______________________________。
【答案】C3H6O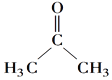 CH3CH2CHO+2Ag(NH3)2OH
CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2OCH2===CH—CH2OH(或
CH3CH2COONH4+2Ag↓+3NH3+H2OCH2===CH—CH2OH(或![]() —OH)
—OH)
【解析】
(1)有机化合物的蒸汽的密度是同条件下氢气的29倍,有机物的相对分子质量=29×2=58,5.8 g A的物质的量n(A)=5.8g÷58g/mol=0.1mol,燃烧生成13.2 g CO2的物质是量为n(CO2)=13.2g÷44/mol=0.3mol,5.4 g H2O的物质的量为n(H2O)=5.4g÷18g/mol=0.3mol,则有机物中碳原子个数N(C)=0.3÷0.1=3,氢原子个数N(H)=0.3×2÷0.1=6,氧原子个数N(O)=(58-3×12-6×1)÷16=1,故A的分子式为C3H6O;(2)核磁共振氢谱只有一个吸收峰,则6个H原子等效,所以是丙酮,故答案为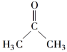 ;(3)①若B可发生银镜反应,说明分子中含有醛基,B为丙醛,反应方程式为CH3CH2CHO+2Ag(NH3)2OH
;(3)①若B可发生银镜反应,说明分子中含有醛基,B为丙醛,反应方程式为CH3CH2CHO+2Ag(NH3)2OH![]() CH3CH2COONH4+2Ag↓+3NH3+H2O;②C无甲基且可与金属钠反应,则C的结构简式中含有一个羟基,其结构可能为CH2=CH—CH2OH(或
CH3CH2COONH4+2Ag↓+3NH3+H2O;②C无甲基且可与金属钠反应,则C的结构简式中含有一个羟基,其结构可能为CH2=CH—CH2OH(或![]() —OH)。
—OH)。

 阅读快车系列答案
阅读快车系列答案