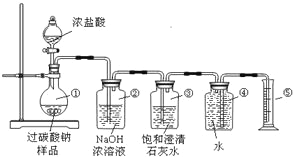
题目内容
【题目】归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
①常温下,pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则有c (Na+) + c(H+)=c(OH-) + c(CH3COO-)
②对已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,生成物的百分含量一定增加
③常温下,AgCl在同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
④常温下,已知醋酸电离平衡常数为Ka;醋酸根水解平衡常数为Kh;水的离子积为Kw;则有:Ka·Kh=Kw
⑤电解精炼铜时,电解质溶液中铜离子浓度不变 。
A.①④ B.①②④ C.①②④⑤ D.①②③④
【答案】A
【解析】
试题分析:①无论醋酸溶液与NaOH溶液怎样混合,电荷守恒有c (Na+) + c(H+)=c(OH) + c(CH3COO-),说法正确;②对已建立化学平衡的某可逆反应,当加入反应物使化学平衡向正反应方向移动时,生成物的百分含量可能减少,说法不正确;③同物质的量浓度的CaCl2和NaCl溶液中,c(Cl-)前者是后者的二倍,AgCl在NaCl溶液中的溶解度更大,说法错误;④常温下,已知醋酸电离平衡常数为Ka、醋酸根水解平衡常数为Kh、水的离子积为Kw,根据醋酸根的水解CH3COO-+H2O![]() CH3COOH+OH-,有:Kh=
CH3COOH+OH-,有:Kh=![]() =
=![]() =
=![]() ,故Ka·Kh=Kw;⑤电解精炼铜时,由于粗铜中的较Cu活泼的金属变为金属阳离子进入电解质溶液中,铜离子浓度减小,说法错误。
,故Ka·Kh=Kw;⑤电解精炼铜时,由于粗铜中的较Cu活泼的金属变为金属阳离子进入电解质溶液中,铜离子浓度减小,说法错误。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) △H<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
N(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2min的平均速率v(Z)=2.0×10-5 mol·L-1·min-1
B. 该温度下此反应的平衡常数K=1.44
C. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大