题目内容
某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。
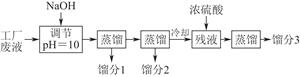
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
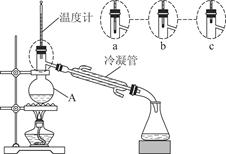
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。
(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010 mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
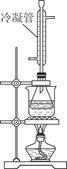
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。
(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗

已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。

(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010 mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。

(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗
(1)乙酸
(2)使乙酸生成乙酸钠;使乙酸乙酯在加热蒸馏时生成乙酸钠和乙醇(答成使乙酸乙酯水解也可)
(3)b
(4)①溶液由无色变为粉红色,半分钟内不褪色 10.00
②使酯水解完全 冷凝回流 2.024
(5)b
(2)使乙酸生成乙酸钠;使乙酸乙酯在加热蒸馏时生成乙酸钠和乙醇(答成使乙酸乙酯水解也可)
(3)b
(4)①溶液由无色变为粉红色,半分钟内不褪色 10.00
②使酯水解完全 冷凝回流 2.024
(5)b
(1)~(2)该流程的原理为:首先加入NaOH溶液调节pH=10,使乙酸转化为难挥发的乙酸钠,同时,乙酸乙酯在加热蒸馏时也发生水解生成难挥发的乙酸钠和乙醇,这样在第一次蒸馏时可得丙酮和乙醇两种馏分;向残液中加入浓硫酸,发生反应2CH3COONa+H2SO4(浓)―→Na2SO4+2CH3COOH,再加热至118 ℃,收集馏出物,得乙酸。
(3)蒸馏装置温度计测量的是蒸出的蒸气的温度,故温度计的感温泡应置于蒸馏烧瓶支管口附近。
(4)①若为优质白酒,则其中醋酸的最小含量为0.30 g/L,其物质的量浓度为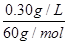 =0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
=0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
②该实验的原理是加入过量的氢氧化钠溶液加热使之充分水解,再用稀硫酸滴定过量的氢氧化钠,通过乙酸乙酯消耗的氢氧化钠的量来求出乙酸乙酯的量。n(CH3COOCH2CH3)=20.00×10-3 L×0.100 mol·L-1-7.70×10-3 L×2×0.100 mol·L-1=0.000 46 mol,故该白酒样品中总酯量为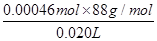 =2.024 g·L-1。
=2.024 g·L-1。
(5)加热时未使用冷凝管可导致乙酸乙酯蒸气逸出,使乙酸乙酯消耗氢氧化钠溶液体积偏小,造成结果偏小;滴定前滴定管内无气泡,滴定后产生气泡,滴定时消耗硫酸体积读数偏小,造成计算时乙酸乙酯消耗氢氧化钠溶液体积偏大,结果偏大;滴定管未用标准硫酸溶液润洗,滴定时消耗硫酸体积偏大,造成乙酸乙酯消耗氢氧化钠溶液体积偏小,结果偏小。
(3)蒸馏装置温度计测量的是蒸出的蒸气的温度,故温度计的感温泡应置于蒸馏烧瓶支管口附近。
(4)①若为优质白酒,则其中醋酸的最小含量为0.30 g/L,其物质的量浓度为
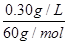 =0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
=0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。②该实验的原理是加入过量的氢氧化钠溶液加热使之充分水解,再用稀硫酸滴定过量的氢氧化钠,通过乙酸乙酯消耗的氢氧化钠的量来求出乙酸乙酯的量。n(CH3COOCH2CH3)=20.00×10-3 L×0.100 mol·L-1-7.70×10-3 L×2×0.100 mol·L-1=0.000 46 mol,故该白酒样品中总酯量为
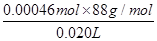 =2.024 g·L-1。
=2.024 g·L-1。(5)加热时未使用冷凝管可导致乙酸乙酯蒸气逸出,使乙酸乙酯消耗氢氧化钠溶液体积偏小,造成结果偏小;滴定前滴定管内无气泡,滴定后产生气泡,滴定时消耗硫酸体积读数偏小,造成计算时乙酸乙酯消耗氢氧化钠溶液体积偏大,结果偏大;滴定管未用标准硫酸溶液润洗,滴定时消耗硫酸体积偏大,造成乙酸乙酯消耗氢氧化钠溶液体积偏小,结果偏小。

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目

 白色沉淀
白色沉淀 沉淀不溶解―→说明试样已变质
沉淀不溶解―→说明试样已变质

 精盐
精盐 溶液颜色无变化
溶液颜色无变化 溶液变红色―→溶液中含有Fe2+
溶液变红色―→溶液中含有Fe2+ 溶液变蓝色―→氧化性:H2O2>I2
溶液变蓝色―→氧化性:H2O2>I2 、⑥S
、⑥S 离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )