题目内容
(14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下: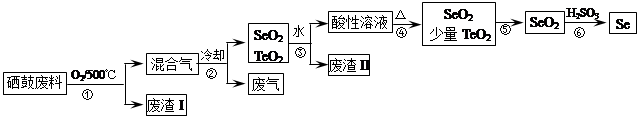
已知:
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
(14分)
(1)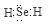
(2)增大接触面积,加快反应速率,使废料充分燃烧 (3)CO2 TeO2
(3)CO2 TeO2
(4)H2SeO3 SeO2+H2O 2H2SO3 + SeO2=Se+2H2SO4
(5)升华,将温度控制在315℃到450℃之间
解析试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为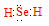 ;
;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华,将温度控制在315℃到450℃之间
考点:考查Se元素的性质,电子式、化学方程式的书写,物质分离方法的判断

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案下列根据实验操作和现象所得出的结论或相应的解释错误的是
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 向盛有0.5mol?L-1 Fe(NO3)2溶液的试管中加入0.5mol?L-1 H2SO4溶液 | 在试管口处出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向PbI2饱和溶液中滴加几滴0.1mol?L-1 KI溶液 | 出现黄色沉淀 | 说明 PbI2饱和溶液中有Pb2+存在 |
| C | 向白色ZnS沉淀上滴加0.1mol?L-1 CuSO4溶液,振摇 | 沉淀变为黑色 | ZnS沉淀转化为CuS沉淀 ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq) |
| D | 用1mol?L-1醋酸溶液和1mol?L-1盐酸分别做导电性实验 | 醋酸溶液对应的灯泡较暗 | 醋酸是弱电解质 |
下列实验方案不可行或结论不正确的是
| A.用润湿的pH试纸测定饱和Na2CO3溶液pH |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀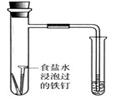 |
| C.向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
| D.向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当 ,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
④误差分析:下列操作会导致测定结果偏高的是 。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.