题目内容
12.科学家从无机物制得的第一个有机化合物是维勒,此后其他科学家又制得了其他的有机化合物,使人们彻底摈弃了“生命力论”.世界上第一次人工合成的蛋白质是结晶牛胰岛素,它是由中国人首先合成的.分析 人们认为有机物只能由动物或植物产生,不可能通过人工的方法将无机物转变为有机物. 这种“生命力论”的思想曾一度扼杀了许多著名化学家的创造力.1828 年,德国化学家维勒在制备无机盐氰酸铵(NH4CNO)时得到了尿素.我国科学家在世界上第一次人工合成蛋白质结晶牛胰岛素.
解答 解:人们认为有机物只能由动物或植物产生,不可能通过人工的方法将无机物转变为有机物. 这种“生命力论”的思想曾一度扼杀了许多著名化学家的创造力.1828 年,德国化学家维勒在制备无机盐氰酸铵(NH4CNO)时得到了尿素. 其他化学家又以无机物为原料合成了醋酸、苹果酸、甲烷、乙 炔等有机化合物,使人们彻底摈弃了““生命力论”. 世界上第一次人工合成的蛋白质是结晶牛胰岛素,它是由中国人首先合成的,
故答案为:维勒;生命力论;结晶牛胰岛素;中.
点评 本题考查蛋白质的性质、化学史等,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
2.镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害.某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
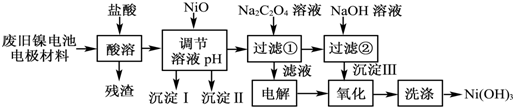
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
回答下列问题:
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;
②已知实验温度时的溶解度:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O;
③某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.4 | 4.2 |
| Fe(OH)3 | 3.8×10-38 | 2.5 | 2.9 |
| Ni(OH)2 | 1.6×10-14 | 7.6 | 9.8 |
(1)慢慢加入NiO以调节溶液的pH至4.2至7.6(填写范围),依次析出沉淀ⅠFe(OH)3和沉淀ⅡAl(OH)3 (填化学式).
(2)写出加入Na2C2O4溶液的反应的化学方程式:NiCl2+Na2C2O4+2H2O═NiC2O4•2H2O↓+2NaCl.
(3)加入Na2C2O4时最好采用饱和的Na2C2O4溶液,理由是尽可能的将溶液中的Ni2+沉淀完全.
(4)检验电解滤液时阳极产生的气体的方法:用湿润的淀粉碘化钾试纸试纸变蓝色.
(5)实验中,沉淀Ⅲ的氧化是在碱性条件下发生的.写出该“氧化”反应的离子方程式:2Ni(OH)2+2OH-+Cl2═2Ni(OH)3+2Cl-.
(6)如何检验Ni(OH)3已洗涤干净?取最后一次洗涤液,加入AgNO3溶液,如有白色沉淀生成,再加入稀硝酸,若沉淀不溶解,证明沉淀已洗涤干净.
3.已知反应:①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol.下列结论正确的是( )
②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol.下列结论正确的是( )
| A. | 碳的燃烧热小于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
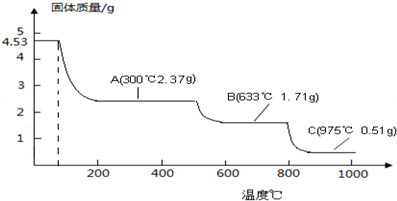
20.纳米氧化铝是一种重要的功能陶瓷材料,可通过加热分解硫酸铝铵晶体(NH4Al (SO4)2•12H2O)得到. 取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.
则下列说法不正确的是( )
则下列说法不正确的是( )

| A. | A物质的水溶液与过量NaOH溶液在加热时反应的离子方程式为:Al3++4OH-═AlO2-↓+2H2O | |
| B. | 633℃时剩余固体成分为Al2(SO4)3 | |
| C. | 取B物质于975℃灼烧得到两种产物分别为Al2O3和SO3 | |
| D. | 硫酸铝铵晶体分解的最低温度为80℃ |
7.下列化学反应中,能用离子方程式H++OH-=H2O 表示的是( )
| A. | 硝酸溶液和氢氧化钠溶液 | B. | 氢氧化铁胶体溶液和盐酸溶液 | ||
| C. | 氢氧化钡溶液和硫酸溶液 | D. | 氢氧化钠和醋酸溶液 |
17. 如图所示,外界条件(温度、压强)的变化的对下列反应的影响L(s)+G(g)?2R(g)(正反应为吸热反应),在图中,y轴是指( )
如图所示,外界条件(温度、压强)的变化的对下列反应的影响L(s)+G(g)?2R(g)(正反应为吸热反应),在图中,y轴是指( )
 如图所示,外界条件(温度、压强)的变化的对下列反应的影响L(s)+G(g)?2R(g)(正反应为吸热反应),在图中,y轴是指( )
如图所示,外界条件(温度、压强)的变化的对下列反应的影响L(s)+G(g)?2R(g)(正反应为吸热反应),在图中,y轴是指( )| A. | 平衡混合气中R的体积分数 | B. | 平衡混合气体G的体积分数 | ||
| C. | 平衡时反应物G的转化率 | D. | 平衡时反应物L的转化率 |
4.把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
| A. | 稀硫酸 | B. | Fe(NO3)3溶液 | C. | CuSO4溶液 | D. | AgNO3溶液 |
1.下列措施不合理的是( )
| A. | 用CCl4萃取碘水中的碘 | |
| B. | 将饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体 | |
| C. | 将混有少量HCl的Cl2通入饱和食盐水溶液中除去HCl | |
| D. | 常温下铝箔放在浓HNO3中,生成H2 |
2.下列叙述中正确的是( )
| A. | 常温常压下含有NA个原子的氦气体积约为22.4L | |
| B. | 常温常压下,O2和O3的混合物16g中约含有6.02×1023个氧原子 | |
| C. | 在0℃,101KPa时,22.4L氢气中含有NA个氢原子 | |
| D. | 标准状况下,33.6LH2O含有1.5NA个H2O分子 |