题目内容
20.纳米氧化铝是一种重要的功能陶瓷材料,可通过加热分解硫酸铝铵晶体(NH4Al (SO4)2•12H2O)得到. 取4.53g 硫酸铝铵晶体加热分解,最终剩余0.51g Al2O3固体.加热过程中,固体质量随温度的变化如图所示.则下列说法不正确的是( )
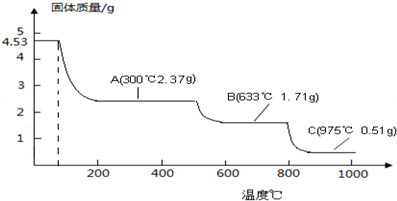
| A. | A物质的水溶液与过量NaOH溶液在加热时反应的离子方程式为:Al3++4OH-═AlO2-↓+2H2O | |
| B. | 633℃时剩余固体成分为Al2(SO4)3 | |
| C. | 取B物质于975℃灼烧得到两种产物分别为Al2O3和SO3 | |
| D. | 硫酸铝铵晶体分解的最低温度为80℃ |
分析 A、NH4Al (SO4)2•12H2O溶于水,溶液中的铵根离子结合氢氧根离子生成一水合氨,铝离子和过量氢氧根离子结合生成偏铝酸根离子;
B、4.53g 硫酸铝铵晶体物质的量=$\frac{4.53g}{453g/mol}$=0.01mol,若为Al2(SO4)3 物质的量为0.05mol,计算硫酸铝物质的质量分析判断;
C、B物质通过计算分析为硫酸铝,灼烧分解生成氧化铝和三氧化硫;
D、图象分析晶体分解的温度近似为80°C.
解答 解:A、NH4Al (SO4)2•12H2O溶于水,溶液中的铵根离子结合氢氧根离子生成一水合氨,铝离子和过量氢氧根离子结合生成偏铝酸根离子,反应的离子方程式为:NH4++Al3++5OH-═AlO2-↓+2H2O+NH3•H2O,故A错误;
B、4.53g 硫酸铝铵晶体物质的量=$\frac{4.53g}{453g/mol}$=0.01mol,若为Al2(SO4)3 物质的量为0.05mol,计算硫酸铝物质的质量=0.05mol×342g/mol=1.71g,分析图象判断,633℃时剩余固体成分为Al2(SO4)3,故B正确;
C、B物质通过计算分析为硫酸铝,依据硫酸盐分解的过程分析,灼烧分解生成氧化铝和三氧化硫,故C正确;
D、图象分析晶体分解的温度近似为80°C,故D正确;
故选A.
点评 本题考查了图象的分析判断,物质的组成计算,分解成分的分析应用,掌握离子性质和题干信息的理解应用时解题关键,题目难度中等.

练习册系列答案
相关题目
10.A、B、C、D、E四种短周期元素,元素A在地壳中含量最高,充有元素B单质蒸气的灯透雾能力强,常用于道路和广场的照明.E的最外层电子数与其电子总数比为3:8,D的单质常用作电脑的芯片材料.元素C的合金是日常生活中常用的合金( )
| A. | 元素B、C、D的简单氢化物中化学键类型相同 | |
| B. | 原子半径A>B>C>D>E | |
| C. | 由元素A、E形成的单质晶体类型相同 | |
| D. | AB形成的化合物中只可能含离子键 |
15.如图实验装置一般不用于分离物质的是( )
| A. |  | B. |  | C. |  | D. |  |
5.下列措施不合理的是( )
| A. | 用SO2漂白纸浆和草帽 | |
| B. | 用硫酸清洗锅炉中的水垢 | |
| C. | 实验室盛装NaOH玻璃试剂瓶用橡皮塞 | |
| D. | 漂白粉应该要密封,干燥保存 |
9.下列说法正确的是( )
| A. | 用乙醇萃取碘水中的碘 | |
| B. | 淀粉、油脂和蛋白质都是高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | 光导纤维是将太阳能转化为电能的常用材料 |
10.在一定条件下,使CO和O2的混合气体30g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,下列关于混合气体的描述不正确的是( )
| A. | 原混合气体的平均摩尔质量为30g/mol | |
| B. | 原混合气体中CO和O2的物质的量之比为1:1 | |
| C. | 反应后的混合气体含有O2和CO2 | |
| D. | 反应后O2的物质的量比反应前的多 |
 2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.
2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置. .
.