题目内容
3.已知反应:①101kPa时,2C(s)+O2(g)═2CO(g);△H=-221kJ/mol②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol.下列结论正确的是( )
| A. | 碳的燃烧热小于110.5 kJ/mol | |
| B. | ①的反应热为221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量小于57.3 kJ |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B、反应分吸收热量,放出热量两种情况,放热反应的反应热为负值,吸热反应的反应热为正值;
C、中和热是指稀的强酸和强碱反应生成1mol水放出的热量;
D、醋酸为弱电解质,电离过程为吸热过程.
解答 解:A、由反应①可知,1mol碳燃烧生成CO放出的热量为110.5 kJ,CO燃烧生成二氧化碳继续放出热量,故1mol碳完全燃烧放出的热量大于110.5 kJ,碳的燃烧热大于110.5 kJ/mol,故A错误;
B、反应热包含符号,①的反应热为-221 kJ/mol,故B错误;
C、稀的强酸、强碱的中和热为△H=-57.3kJ/mol,稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3kJ/mol,故C正确;
D、醋酸是弱电解质,电离需吸收热量,稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量小于57.3 kJ,故D正确,
故选CD.
点评 本题考查燃烧热、中和热概念的理解及有关计算,注意知识的归纳和整理是关键,难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
13.下列叙述错误的是( )
| A. | 煤油可用作燃料或保存少量金属钠 | |
| B. | 淀粉和蛋白质都能水解,但水解产物不同 | |
| C. | 乙烯和苯都能使溴水褪色,褪色的原因相同 | |
| D. | 油脂里饱和烃基的相对含量越大,油脂的熔点越高 |
14.下列说法不正确的是( )
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺都符合绿色化学的思想 | |
| B. | 在现代化学工业中催化剂的应用十分普遍,对于给定条件下反应物之间能够同时发生多个反应时,理想催化剂还可以大幅度提高目标产物在最终产物中的比率 | |
| C. | 石油裂解、煤的气化、橡胶老化、海水制镁、纯碱晶体风化、纤维素制火棉等过程中都包含化学变化 | |
| D. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为“细颗粒物“,PM2.5在空气中只形成气溶胶 |
18.在光照条件下,将1molCH4与Cl2反应,得到等物质的量的4种取代物,则耗Cl2物质的量为( )
| A. | 1mol | B. | 2mol | C. | 2.5mol | D. | 10mol |
15.如图实验装置一般不用于分离物质的是( )
| A. |  | B. |  | C. |  | D. |  |
13.下列式子书写正确的是( )
| A. | 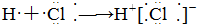 | B. |  | ||
| C. |  | D. |  |
 2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置.
2009年诺贝尔化学奖奖励的是对生命一个核心过程的研究--核糖体将DNA信息“翻译”成生命,三位科学家利用X射线结晶学技术标出了构成核糖体的无数个原子每个所在的位置. .
.