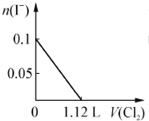
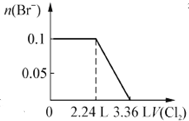
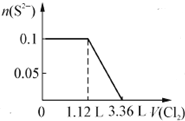
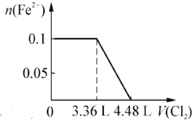
题目内容
14.请填写下列空白处:实验室里要配制500mL0.2mol/L的Na2CO3溶液.实验步骤大致有:A、在天平上称出10.6g Na2CO3固体,把它放在烧杯里,用适量的蒸馏水溶解.
B、把得到的溶液小心地沿着玻璃棒注入500mL的容量瓶中.
C、用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中.
D、继续向容量瓶中加蒸馏水至液面距刻度1-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切.
E、将瓶塞塞紧,充分摇匀.
F、将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶.
分析 A.依据m=CVM计算需要溶质碳酸钠的质量;
B.依据配制溶液的体积选择合适的容量瓶,依据移液的正确操作方法解答;
D.依据定容的正确操作解答.
解答 解:A.配制500mL0.2mol/L的Na2CO3溶液,需要碳酸钠的质量m=0.2mol/L×0.5L×106g/mol=10.6g;
故答案为:10.6;
B.要配制500mL0.2mol/L的Na2CO3溶液,应选择500mL容量瓶;因为容量瓶瓶颈较细,所以移液时应用玻璃棒引流;
故答案为:玻璃棒;500;
D.定容时,继续向容量瓶中加蒸馏水至液面距刻度1-2cm,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切;
故答案为:1-2;胶头滴管.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作方法是解题关键,题目难度不大,侧重考查学生对基础实验操作的熟练程度.

练习册系列答案
相关题目
4.在101kPa时,测得氢气燃烧的热化学方程表示式如下:
①2H2(g)+02(g)=2H20(1)△H=-571.6kJ/mol
②2H2(g)+02(g)═2H20(g)△H=-483.6kJ/mol
则H2的燃烧热为( )
①2H2(g)+02(g)=2H20(1)△H=-571.6kJ/mol
②2H2(g)+02(g)═2H20(g)△H=-483.6kJ/mol
则H2的燃烧热为( )
| A. | -285.8kJ/mol | B. | 285.8kJ/mol | C. | -241.8 kJ/mol | D. | 241.8kJ/md |
5.下列一种变化与其它三种变化有本质区别,这种变化是( )
| A. | 碳燃烧产生气体 | B. | 硫燃烧产生气体 | ||
| C. | 高锰酸钾加热产生气体 | D. | 水加热产生气体 |
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,0.5 molNO与0.5 molO2混合后气体分子数为0.75NA | |
| B. | 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3 NA | |
| C. | 0.1molAlCl3完全转化为氢氧化铝胶体,生成O.l NA个胶体粒子 | |
| D. | 1.0 L1.0 mol.L-lNa2 SiO3水溶液中含有的氧原子数为3 NA |
9.据报道,科学家发现了一种新元素,它的原子核内有159个中子,质量数为275,该元素原子的核外电子数为( )
| A. | 111 | B. | 116 | C. | 272 | D. | 433 |
6.下列说法不正确的是( )
| A. | “煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| B. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| C. | 2014年诺贝尔化学奖授予美国科学家埃里克•贝齐格、威廉•莫纳和德国科学家斯特凡•黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,利用此类显微镜可以观察病毒以及活细胞内蛋白质等大分子 | |
| D. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油,实现厨余废物合理利用 |