题目内容
19.饱和氯水与石灰石的反应是制取较浓HCLO溶液的方法之一.《化学教育》报道了如下研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生. 经检测,上述实验中产生的无色气体均为CO2.
请回答:
(1)反应后所得的溶液漂白性增强的原因是CaCO3消耗了氯水中的HC1,使Cl2+H2O?HCl+HClO平衡向右移动,HClO浓度增大,溶液的漂白性增强.
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有的溶质的化学式为Ca(HCO3)2.
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.
(3)实验结束后检测量筒收集到的气体除CO2外还混有O2,请写出I中产生O2的化学反应方程式2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl↑+O2↑.
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造 成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是在导管末端再连接长导管,使导管的出口接近量筒底部或将水换成熟水.
分析 (1)从Cl2+H2O?HCl+HClO 平衡移动的角度分析;
(2)氯气与水反应Cl2+H2O?HCl+HClO,生成HClO,因为碳酸钙是过量的,并且反应中有二氧化碳生成,因此碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙CaCO3+H2O+CO2=Ca(HCO3)2,因此第二份与稀盐酸混合Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,据此分析;
(3)I中氯气与水反应生成盐酸和次氯酸,次氯酸加热可以分解生成氯化氢和氧气;
(4)从二氧化碳微溶于水的角度分析.
解答 解:(1)CaCO3 消耗了氯水中的 HC1,使 Cl2+H2O?HCl+HClO 平衡向右移动,HClO浓度增大,反应中产生的气体为二氧化碳(氯化氢与碳酸钙反应所得),而二氧化碳溶于水呈酸性,抑制了次氯酸的电离平衡,使溶液中存在了浓度更高的次氯酸,因此将滤液滴在有色布条上,发现其比氯水的漂白性更强,
故答案为:CaCO3 消耗了氯水中的 HC1,使 Cl2+H2O?HCl+HClO 平衡向右移动,HClO浓度增大,溶液的漂白性增强;
(2)氯气与水反应Cl2+H2O?HCl+HClO,生成HClO,因为碳酸钙是过量的,并且反应中有二氧化碳生成,因此碳酸钙和二氧化碳和水反应生成了可溶于水的碳酸氢钙CaCO3+H2O+CO2=Ca(HCO3)2,因此第二份与稀盐酸混合Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,所以②的滤液中含有的溶质除了极少量的氯气外,还有HClO、Ca(HCO3)2、CaCl2,
故答案为:Ca(HCO3)2;
(3)I中氯气与水反应生成盐酸和次氯酸,次氯酸加热可以分解生成氯化氢和氧气,反应的方程式为2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl↑+O2↑,
故答案为:2HClO$\frac{\underline{\;\;△\;\;}}{\;}$2HCl↑+O2↑;
(4)因二氧化碳微溶于水,并且压强越大,气体的溶解度越大,为减少因二氧化碳的溶解而导致二氧化碳的损失,可使导管的出口接近量筒底部将水换成熟水,减小二氧化碳的溶解,
故答案为:在导管末端再连接长导管,使导管的出口接近量筒底部或将水换成熟水.
点评 该题综合性较强,在定性研究中要求考生熟练掌握化学平衡移动和书写化学方程式,而在定量研究中则以简答题的形式要求考生答对和答全有关实验操作基本技术问题并进一步的思考实验现象的原因,较大程度地造成答案的难以确定和完整,题目难度中等.

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案| A. | 生成沉淀的反应 | B. | 有单质参与的反应 | ||
| C. | 歧化反应 | D. | 复分解反应 |
| A. | 向AlCl3溶液中滴入NaOH溶液 | |
| B. | 向NaOH溶液中通入SO2气体 | |
| C. | 向浓硝酸中加入过量铜粉 | |
| D. | 向MgCl2、H2SO4的混合液中滴入过量Ba(OH)2溶液 |
| A. | 上述反应中,Si元素化合价不变 | B. | 氮化硅晶体中含有Si4+ | ||
| C. | Si3N4属于氮化物 | D. | 上述反应属于氧化还原反应 |
 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.
燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等.(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物:
①CH4 (g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-570kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则CH4 (g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-865 kJ•mol-1.
(2)将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
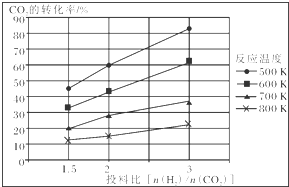
已知在压强为a MPa下,该反应在不同温度、不同投料比时,CO2的转化率见如图:
①此反应为放热(填“放热”、“吸热”);若温度不变,提高投料比[$\frac{n({H}_{2})}{n(C{O}_{2})}$],则K将不变(填“增大”、“减小”或“不变”).
②在a MPa和一定温度下,将6mol H2和2mol CO2在2L密闭容器中混合,当该反应达到平衡时,测得平衡混合气中CH3OCH3的体积分数约为16.7%(即$\frac{1}{6}$),此时CO2的转化率为80%
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是b=2a,a>1(用含a、b的数学式表示).
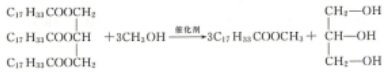 .
.
 ,DMCCH3OCOOCH3.
,DMCCH3OCOOCH3.