题目内容
19.已知H2S+I2═2HI+S↓,现向含S2-、Fe2+、Br-、I-各0.1mol的溶液中通入Cl2,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )| A. | 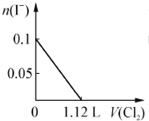 | B. | 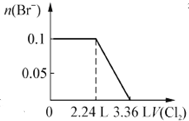 | ||
| C. | 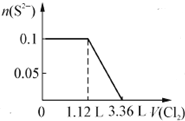 | D. | 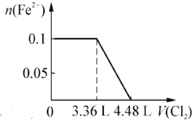 |
分析 离子还原性S2->I->Fe2+>Br-,故首先发生反应S2-+Cl2=S+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断.
解答 解:离子还原性S2->I->Fe2+>Br-,故首先发生反应S2-+Cl2=S+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,
A、0.1molS2-完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1molS2-完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molI-完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,故A错误;
B.S2-、I-、Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=2Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故溴离子完全反应时消耗氯气的体积为4.48L+0.05mol×22.4L/mol=5.6L,图象中氯气的体积不符合,故B错误;
C.由S2-+Cl2=S+2Cl-,可知,0.1molS2-完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,故C错误;
D.0.1molS2-完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际符合,故D正确;
故选D.
点评 本题以图象形式考查氧化还原反应、有关离子反应计算等,难度中等,确定离子反应发生的先后顺序是解题的关键.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | 1mol该有机物在加热和催化剂作用下,最多能和4 molH2反应 | |
| B. | 该有机物能使溴水褪色也能使酸性KMnO4溶液褪色 | |
| C. | 该有机物属于烃 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
| A. | 含4gNaOH的溶液1L | B. | 含0.1gNaOH的溶液1L | ||
| C. | 含0.2molH2SO4的溶液0.5L | D. | 含19.6g H2SO4的溶液1L |
| A. | 碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-═NH3↑+H2O | |
| C. | 将过量二氧化硫气体入冷氨水中:SO2+NH3•H2O═HSO3-+NH4+ | |
| D. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+═H2SiO3↓ |