题目内容
【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应。请回答:
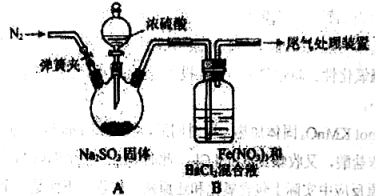
(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 。
(2)装置B中产生了白色沉淀,其成分是 。
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;
假设2:在酸性条件下SO2与NO3-反应;
假设3: 。
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容。
实验步骤 | 预期的现象和结论 |
①测定B中实验所用混合溶液的__________ ②配制具有相同 的稀硝酸与BaCl2的混合液并通入适当的 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
经验证假设2成立,则验证过程中发生的离子方程式是 。
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由 。
【答案】
(1)排尽装置内的空气;
(2)BaSO4 Fe3+、NO3-同时氧化SO2;
(3)①pH ②pH N2(或其它不反应的气体);4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+(未写Ba2+与BaSO4也对);否;未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+
【解析】
试题分析:(1)二氧化硫具有还原性,为了防止二氧化硫被空气中的氧气氧化,A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,将装置内的空气排尽,故答案为:排尽装置内的空气;
(2)二氧化硫具有还原性,铁离子具有氧化性、酸性条件下硝酸根具有强氧化性,二氧化硫被氧化生成硫酸根离子,进而生成硫酸钡沉淀,Fe3+具有氧化性,酸性条件下NO3-也具有强氧化性,观点3:SO2和Fe3+、酸性条件下NO3-都反应,故答案为:BaSO4;SO2和Fe3+、酸性条件下NO3-都反应;
(3)某同学设计实验验证假设2,步骤为①测定B中实验所用混合溶液的pH;②配制具有相同pH的稀硝酸与BaCl2的混合液并通入适当的氮气;③将SO2通入上述溶液中,若出现白色沉淀则假设2成立;若不出现白色沉淀则假设2不成立;若假设2成立,则二氧化硫被硝酸根离子氧化为硫酸根离子,进而生成硫酸钡沉淀,反应的离子方程式为4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+;若假设1、假设2都成立,则假设3不能成立,原因是未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+,故答案为:①pH ②pH N2(或其它不反应的气体);4SO2+NO3-+5H2O+4Ba2+=4BaSO4↓+NH4++6H+(未写Ba2+与BaSO4也对);否;未检验Fe3+与此条件下NO3-的氧化性强弱或未检验是否生成Fe2+。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案