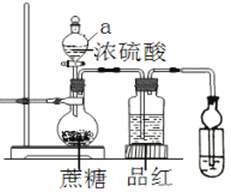
题目内容
【题目】下列说法正确的是( )
A.MgF2晶体中的化学键是共价键
B.某物质在熔融态能导电,则该物质中一定含有离子键
C.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
D.N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
【答案】D
【解析】
试题分析:A. MgF2晶体中的化学键是离子键,A错误;B.金属单质的熔融态能导电,但是不含有离子键,B错误;C.二氧化碳与水反应生成碳酸,发生了化学反应,共价键断裂,C错误;D. N2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构,D正确。故答案D。

练习册系列答案
相关题目
【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应。请回答:
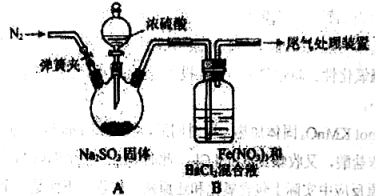
(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 。
(2)装置B中产生了白色沉淀,其成分是 。
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;
假设2:在酸性条件下SO2与NO3-反应;
假设3: 。
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容。
实验步骤 | 预期的现象和结论 |
①测定B中实验所用混合溶液的__________ ②配制具有相同 的稀硝酸与BaCl2的混合液并通入适当的 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
经验证假设2成立,则验证过程中发生的离子方程式是 。
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由 。