题目内容
9.下列三种有机物是某些药物中的有效成分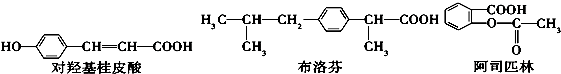
下列说法正确的是( )
| A. | 三种有机物都是芳香烃 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 将等物质的量的三种物质加入NaOH溶液中,阿司匹林消耗NaOH最多 | |
| D. | 1 mol对羟基桂皮酸最多可以和2 mol NaHCO3反应 |
分析 A.含有苯环的烃属于芳香烃;
B.苯环上有几种氢原子,则苯环上就有几种一氯代物;
C.酚羟基、酯基水解生成的酚羟基和羧基、羧基能和氢氧化钠反应;
D.只有羧基能和碳酸氢钠反应.
解答 解:A.含有苯环的烃属于芳香烃,三种物质中都含有O元素,所以都不是芳香烃,故A错误;
B.苯环上有几种氢原子,则苯环上就有几种一氯代物,对羟基桂皮酸、布洛芬中苯环上都含有两种氢原子阿司匹林分子中苯环上含有4种氢原子,所以对羟基桂皮酸、布洛芬中苯环上的氢原子若被氯原子取代,其一氯代物都只有2种,阿司匹林中苯环上有4种一氯代物,故B错误;
C.酚羟基、酯基水解生成的酚羟基和羧基、羧基能和氢氧化钠反应,1mol有机物与足量氢氧化钠反应,对羟基桂皮酸最多消耗2mol氢氧化钠、布洛芬最多消耗1mol氢氧化钠、阿司匹林最多消耗3mol氢氧化钠,所以阿司匹林消耗氢氧化钠最多,故C正确;
D.只有羧基能和碳酸氢钠反应,1 mol对羟基桂皮酸最多可以和1 mol NaHCO3反应,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,注意只有羧基能和碳酸氢钠反应,酚羟基和羧基能和碳酸钠反应,易错选项是C.

练习册系列答案
相关题目
20.下列物质含有离子键的是( )
| A. | H2 | B. | NH3 | C. | KCl | D. | H2O |
17.下列说法不正确的是( )
| A. | 结构片段为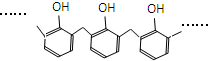 的高聚物,其单体是甲醛和苯酚 的高聚物,其单体是甲醛和苯酚 | |
| B. | 按系统命名法,化合物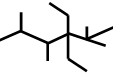 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| C. | 科学家发现一种新细菌的DNA链中有砷(As)元素,该As元素最有可能取代了普通DNA链中的P元素 | |
| D. | 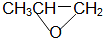 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物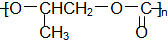 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 |
4.下列说法中不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 氯化钙能与Na2CO3反应,也能与NaHCO3反应 | |
| D. | 与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少 |
14.某有机物的分子式为C3H6O2,在酸性条件下可水解为甲和乙两种有机物.在相同温度和压强下,相同质量的甲和乙的蒸气所占的体积相同.若乙有同分异构体而甲没有,则乙不能发生的反应类型为( )
| A. | 取代 | B. | 酯化 | C. | 氧化 | D. | 加成 |
1.某纯碱厂技术科的人员对该厂纯碱样品的质量进行检验.其中能够说明纯碱样品中可能含有杂质(NaHCO3)的实验是( )
①样品溶于水,并加入足量的澄清石灰水,变浑浊;
②样品溶于水,并加入足量的BaCl2溶液,变浑浊;
③样品在硬质试管中加强热,排出的气体通入澄清石灰水,变浑浊;
④向样品中滴加稀盐酸,排出的气体通入澄清石灰水,变浑浊.
①样品溶于水,并加入足量的澄清石灰水,变浑浊;
②样品溶于水,并加入足量的BaCl2溶液,变浑浊;
③样品在硬质试管中加强热,排出的气体通入澄清石灰水,变浑浊;
④向样品中滴加稀盐酸,排出的气体通入澄清石灰水,变浑浊.
| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | 只有③ |
18.下列做法不正确的是( )
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.1mol•L-1碳酸钠溶液 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
19.(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
 氯及其化合物在生产,生活中有着广泛的用途,回答下列问题:
氯及其化合物在生产,生活中有着广泛的用途,回答下列问题: