题目内容
14.下列对阿佛加德罗常数NA的说法正确的是( )| A. | 分子数为0.5NA的氧化钠,其质量为31克 | |
| B. | 标准状况下,4.48升乙烯分子中共含σ键数目为NA | |
| C. | 硫化钾0.5mol/l的溶液中含K+数为NA | |
| D. | 把1mol和0.3molN2与H2混合在一定条件下充分反应生成NH3分子数为0.2NA |
分析 A.氧化钠为离子晶体;
B.单键为σ键,双键含有1个σ键和1个π键,三键含有1个σ键和2个π键,1mol乙烯分子中的σ键为5mol;
C.溶液体积未知;
D.氮气与氢气生成氨气为可逆反应,不能进行到底.
解答 解:A.氧化钠为离子晶体不存在分子,故A错误;
B.标准状况下,4.48升乙烯物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,含有σ键为0.2×5=1mol,数目为NA,故B正确;
C.溶液体积未知,无法计算钾离子个数,故C错误;
D.氮气与氢气生成氨气为可逆反应,不能进行到底,所以把1mol和0.3molN2与H2混合在一定条件下充分反应生成NH3分子数小于0.2NA,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,注意物质与微粒的关系,注意乙烯分子的结构特点,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列变化需要吸收能量的是( )
| A. | 1S22S22P63S1→1S22S22P6 | |
| B. | 3S23P5→3S23P6 | |
| C. | 2P${\;}_{x}^{2}$2P${\;}_{y}^{1}$2P${\;}_{z}^{1}$→2P${\;}_{x}^{1}$2P${\;}_{y}^{1}$2P${\;}_{x}^{2}$ | |
| D. | 2H→H-H |
5.下面是实验室可制取氨气的装置和选用的试剂,其中正确的是( )
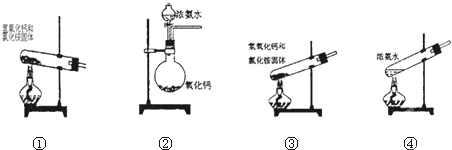

| A. | ①②④ | B. | 只有④ | C. | ①② | D. | 只有③ |
2.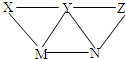 现有H2SO4.BaCl2.K2CO3.FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应.下列推断不合理的是( )
现有H2SO4.BaCl2.K2CO3.FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应.下列推断不合理的是( )
 现有H2SO4.BaCl2.K2CO3.FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应.下列推断不合理的是( )
现有H2SO4.BaCl2.K2CO3.FeSO4和氯水五种溶液,有如图所示的相互关系,图中每条连线两端的物质可以发生化学反应.下列推断不合理的是( )| A. | X一定为H2SO4 | B. | Y一定为K2CO3 | C. | Z可能是氯水 | D. | M可能为FeSO4 |
6.下列各组离子能在强酸性的溶液中大量共存,且溶液呈无色的是( )
| A. | K+、Na+、MnO4-、SO42- | B. | K+、Na+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、NO3- | D. | Ba2+、K+、OH-、SO42- |
4.分子式为 C8H10的苯的同系物,其苯环上的一氯代物的种类有( )
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |

