题目内容
4.下列变化需要吸收能量的是( )| A. | 1S22S22P63S1→1S22S22P6 | |
| B. | 3S23P5→3S23P6 | |
| C. | 2P${\;}_{x}^{2}$2P${\;}_{y}^{1}$2P${\;}_{z}^{1}$→2P${\;}_{x}^{1}$2P${\;}_{y}^{1}$2P${\;}_{x}^{2}$ | |
| D. | 2H→H-H |
分析 A、电子克服原子核的束缚需要吸收能量;
B、原子得到电子变成阴离子的过程是放热的过程;
C、电子在相同能级中发生变化,没有能量变化;
D、新化学键的形成过程是放热的过程.
解答 解:A.电子克服原子核的束缚需要吸收能量,所以原子失去电子需要吸收能量,故A正确;
B.原子得到电子后把不稳定结构变成稳定结构,能量降低,所以放出能量,故B错误;
C.由于电子的跃迁发生在能量相同的能级中,故无能量变化,故C错误;
D.化学键断裂需要吸收能量,形成化学键需要放出能量,故D错误;
故选A.
点评 本题考查了变化与能量的关系,明确放热、吸热的原因即可解答,易错选项是C,注意px、pz能量相同,为易错点.

练习册系列答案
相关题目
14. 图如中所示化合物A(fumimycin)是从微生物中分离得到的它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
图如中所示化合物A(fumimycin)是从微生物中分离得到的它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
 图如中所示化合物A(fumimycin)是从微生物中分离得到的它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
图如中所示化合物A(fumimycin)是从微生物中分离得到的它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )| A. | 该化合物A的分子式为:C15H15O6N | |
| B. | 化合物A可以水解得到2种有机物 | |
| C. | 化合物A可与 H2发生加成反应,1molA最多消耗H22mol | |
| D. | 化合物A与足量的溴水反应,1molA可以消耗5molBr2 |
15.类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | Mg与CuSO4反应置换出Cu,故Na与CuSO4反应也可以置换出Cu | |
| C. | 次氯酸可以令有色布条褪色,因其强氧化性,故过氧化钠也可以令有色布条褪色 | |
| D. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 |
12.下列化学实验基本操作中正确的是( )
| A. | 分液时,碘的四氯化碳溶液从分液漏斗下口放出,水层从上口倒出 | |
| B. | 蒸馏时,水从冷凝管上部通入,从下部流出 | |
| C. | 向某溶液中加入AgNO3溶液,生成白色沉淀,该溶液中一定含有Cl- | |
| D. | 称量时,将纯碱放在称量纸上置于托盘天平的右盘,将砝码放在托盘天平的左盘 |
19.下列物质放置在空气中,因发生氧化还原而变质的是( )
| A. | Na2CO3 | B. | NaOH | C. | NaCl | D. | Na |
13.向FeCl3和BaCl2的混合溶液中通入SO2气体,下列有关现象及原理解释不正确的是( )
| A. | 该实验涉及的氧化还原反应中FeCl3是氧化剂 | |
| B. | 该实验中会产生BaSO3白色沉淀 | |
| C. | 溶液颜色由棕黄色变为浅绿色表明SO2有还原性 | |
| D. | 由于反应产生H+,所以反应后溶液酸性增强 |
14.下列对阿佛加德罗常数NA的说法正确的是( )
| A. | 分子数为0.5NA的氧化钠,其质量为31克 | |
| B. | 标准状况下,4.48升乙烯分子中共含σ键数目为NA | |
| C. | 硫化钾0.5mol/l的溶液中含K+数为NA | |
| D. | 把1mol和0.3molN2与H2混合在一定条件下充分反应生成NH3分子数为0.2NA |
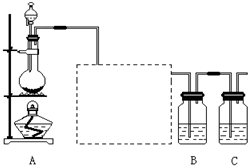 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: