题目内容
5.下面是实验室可制取氨气的装置和选用的试剂,其中正确的是( )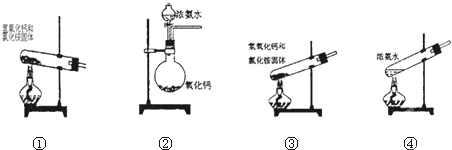
| A. | ①②④ | B. | 只有④ | C. | ①② | D. | 只有③ |
分析 ①氯化铵与氢氧化钙固体在加热条件下生成氨气;
②CaO遇水生成Ca(OH)2,同时放出大量热量,有利于氨气的生成;
③氯化铵与氢氧化钙固体在加热条件下生成氨气,试管口应向下倾斜;
④浓氨水易挥发,加热促进氨气的逸出.
解答 解:①氯化铵与氢氧化钙固体在加热条件下生成氨气,反应物为固体与固体加热,注意试管口略向下倾斜,防止损坏试管,故正确;
②向CaO中滴加浓氨水,CaO遇水生成Ca(OH)2,同时放出大量热量,使浓氨水中的氨气逸出,故正确;
③氯化铵与氢氧化钙固体在加热条件下生成氨气,试管口应向下倾斜,故错误;
④浓氨水易挥发,加热促进氨气的逸出,用酒精灯直接加热盛有浓氨水的试管即可制备氨气,故正确;
故选:A.
点评 本题考查氨气的实验室制备,掌握氨气的制备原理和化学性质是解答的关键,注意发生装置的选择依据,题目难度不大.

练习册系列答案
相关题目
15.类推的思想方式在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证.以下类推的结论中正确的是( )
| A. | SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色 | |
| B. | Mg与CuSO4反应置换出Cu,故Na与CuSO4反应也可以置换出Cu | |
| C. | 次氯酸可以令有色布条褪色,因其强氧化性,故过氧化钠也可以令有色布条褪色 | |
| D. | SO2能使品红溶液褪色,故CO2也能使品红溶液褪色 |
13.向FeCl3和BaCl2的混合溶液中通入SO2气体,下列有关现象及原理解释不正确的是( )
| A. | 该实验涉及的氧化还原反应中FeCl3是氧化剂 | |
| B. | 该实验中会产生BaSO3白色沉淀 | |
| C. | 溶液颜色由棕黄色变为浅绿色表明SO2有还原性 | |
| D. | 由于反应产生H+,所以反应后溶液酸性增强 |
20.已知:
据此推断戊基(-C5H11)的种类数( )
| 烷烃 | CH4 | CH3CH3 | CH3CH2CH3 | C4H10 | |
| CH3CH2CH2CH3 | CH(CH3)3 | ||||
| 核磁共振氢谱吸收峰 | 1种 | 1种 | 2种 | 2种 | 2种 |
| 一氯代物或烷烃基 | 1种 | 1种 | 2种 | 4种 | |
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
10.粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色反应等操作.下列图示对应的操作不规范的是( )
| A. |  称量 | B. | 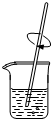 溶解 | C. |  蒸发 | D. | 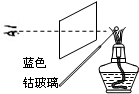 焰色反应 |
14.下列对阿佛加德罗常数NA的说法正确的是( )
| A. | 分子数为0.5NA的氧化钠,其质量为31克 | |
| B. | 标准状况下,4.48升乙烯分子中共含σ键数目为NA | |
| C. | 硫化钾0.5mol/l的溶液中含K+数为NA | |
| D. | 把1mol和0.3molN2与H2混合在一定条件下充分反应生成NH3分子数为0.2NA |
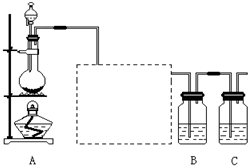 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: