��Ŀ����
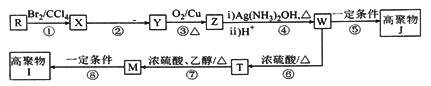
����Ŀ���������������г��������ֽ�����
��1���������������ڻ��������䣬ԭ����_________________________________________����������ס�����ƣ������������ϴ�ЩС�ף������Ӽ�ס����ˮ�У����ܷ����ķ�Ӧ�û�ѧ����ʽ��ʾΪ�� ___________________________��__________________________________�������ᷴӦ�����ӷ���ʽΪ��__________________________________��
��2���ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ����ͼװ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱����ش��ʵ���е����⡣
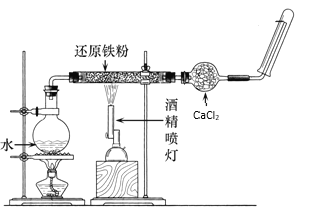
��д���÷�Ӧ�ķ�Ӧ����ʽ����˫���ű������תת�Ʒ������Ŀ��______________________
����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ��������________________________��
�۾ƾ��ƺ;ƾ�������ȵ�ȼ����__________________________��
��������5.6 gFe��ȫ�ܽ���ϡ�����У���ˮ���200 mL��Һ����������������Һ�����ʵ���Ũ��______________��Ӧ��ת�Ƶĵ�������_________�����ɵ������ڱ�״���µ������______________L��
���𰸡���������һ�����ܵ�����ĤAl2O3 ,Al2O3�۵�� 2Na+2H2O == 2NaOH + H2 �� 2Al+2H2O+2NaOH == 2NaAlO2 + 3H2 �� 2Al+6H+ == 2Al3++3H2 �� 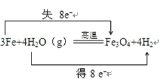 ��ֹ���� �ƾ��� 0.5mol/L 0.2NA 2.24L
��ֹ���� �ƾ��� 0.5mol/L 0.2NA 2.24L
��������
���ݽ��������������ʷ�����𣻸������ʵ����ڻ�ѧ��Ӧ�еļ��������𣻸������ӷ���ʽ����д����������
(1) �������������ڻ��������䣬�����ڽ������ڿ����б�������������һ�����ܵ�����Ĥ����ֹ��Ӧ�Ľ�һ�����У����������Ĥ�۵�ߣ����������ͻ���ϣ���������ס�����ƣ������������ϴ�ЩС�ף������Ӽ�ס����ˮ�У���������ˮ��Ӧ�����������ƣ��������������������Ӧ�����Է�����������Ӧ���ʷ���ʽΪ��2Na+2H2O == 2NaOH + H2 ����2Al+2H2O+2NaOH == 2NaAlO2 + 3H2 ����
�ʴ�Ϊ����������һ���۵�ߵ����ܵ�����Ĥ��2Na+2H2O == 2NaOH + H2 ���� 2Al+2H2O+2NaOH == 2NaAlO2 + 3H2 ����2Al+6H+ == 2Al3++3H2 �� ��
(2) ��������ˮ�����ڸ����·����ķ�Ӧ�У����ϼ����ߵ�Ԫ������Ԫ�أ�ʧȥ���ӣ����ϼ۽���Ԫ������Ԫ�أ��õ����ӣ�����ת�����������ʾ�� ��
��
�ʴ�Ϊ�� ��
��
����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ�������Ƿ�ֹ���У�
�ʴ�Ϊ����ֹ���У�
��Ӧ�ȵ�ȼ�ƾ��ƣ������ȶ���ˮ������ʱ���ڵ�ȼ�ƾ���ƣ�
�ʴ�Ϊ���ƾ��ƣ�
��5.6 gFe�����ʵ���Ϊ��0.1mol�������������������ʵ���Ϊ��0.1mol����Һ�����Ϊ��200mL�����������������ʵ���Ũ��Ϊ��c=![]() =
=![]() =0.5mol/L����Ӧ������Fe��0��������+2�ۣ�ʧȥ2�����ӣ���0.1mol��Feʧȥ0.2mol�ĵ��ӣ�ʧȥ���ӵ���ĿΪ��0.2NA�����ݷ���ʽ��Fe+H2SO4=FeSO4 + H2������֪0.1molFe��������0.1mol������״���£����������Ϊ��V=n��22.4L/mol=0.1mol��22.4L/mol=2.24L��
=0.5mol/L����Ӧ������Fe��0��������+2�ۣ�ʧȥ2�����ӣ���0.1mol��Feʧȥ0.2mol�ĵ��ӣ�ʧȥ���ӵ���ĿΪ��0.2NA�����ݷ���ʽ��Fe+H2SO4=FeSO4 + H2������֪0.1molFe��������0.1mol������״���£����������Ϊ��V=n��22.4L/mol=0.1mol��22.4L/mol=2.24L��
�ʴ�Ϊ��0.5mol/L�� 0.2NA ��2.24L��

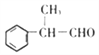
 ����5��2���ϵ�д�
����5��2���ϵ�д�