题目内容
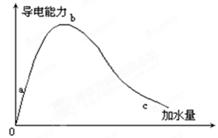
某温度下,分别稀释等pH值的盐酸和醋酸,溶液pH随加入水的体积变化的曲线如右图所示。据图判断下列说法正确的是( )
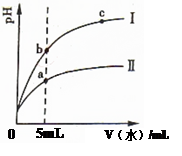

| A.Ⅰ为醋酸稀释时pH变化曲线 |
| B.溶液的导电性:b>a>c |
| C.取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸 |
| D.取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ |
C
试题分析:起始时醋酸和盐酸pH相等,但醋酸中有未电离的醋酸,稀释过程中会电离补充H+,所以稀释过程中盐酸pH变化大,A错误;溶液导电性与离子浓度和离子所带电荷有关,导电性a>b>c,B错误;起始时盐酸和醋酸pH相等,n(CH3COOH)>n(HCl),与足量铁粉反应放出氢气醋酸多,C正确;5mL时,c(H+)醋酸大,与锌反应醋酸快,D错误。
点评:同pH强酸、弱酸稀释相同倍数,强酸pH变化大;同pH强碱、弱碱稀释相同倍数,强碱pH变化大。

练习册系列答案
相关题目
 4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是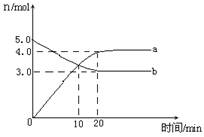
 N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表: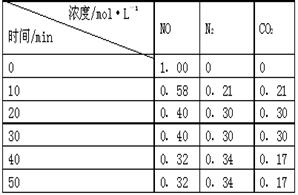
 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,
 PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:下列说法正确的是