题目内容
12.以下物质中能导电且属于电解质的是⑧,属于非电解质的是⑥⑦①漂白粉 ②铜 ③氧气 ④BaSO4固体 ⑤稀硫酸 ⑥蔗糖 ⑦CO2 ⑧熔化的KNO3
写出电离方程式:硫酸铝Al2(SO4)3=2Al3++3SO42-.
分析 电解质是在水溶液中或熔融状态下能导电的化合物;非电解质是在水溶液中和熔融状态下均不能导电的化合物;硫酸铝是强电解质,能完全电离为铝离子和硫酸根,据此分析.
解答 解:①漂白粉是混合物,既不是电解质也不是非电解质;
②铜是单质,既不是电解质也不是非电解质;
③氧气是单质,既不是电解质也不是非电解质;
④BaSO4固体在熔融状态下能导电,故为电解质;
⑤稀硫酸是混合物,既不是电解质也不是非电解质;
⑥蔗糖在水溶液中和熔融状态下均不导电,故为非电解质;
⑦CO2 在水溶液中和熔融状态下均不导电,故为非电解质;
⑧熔化的KNO3能导电,故为电解质.
故为电解质的是⑧,是非电解质的是⑥⑦;
硫酸铝是强电解质,能完全电离为铝离子和硫酸根,电离方程式为:Al2(SO4)3=2Al3++3SO42-.
故答案为:⑧;⑥⑦;Al2(SO4)3=2Al3++3SO42-.
点评 本题考查了电解质、非电解质的判断以及电解质的电离方程式的书写,难度不大,注意基础的掌握.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
2.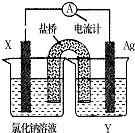 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
 依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )
依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是( )| A. | 电极X的材料是Fe | |
| B. | 电解质溶液Y是AgNO3溶液 | |
| C. | 原电池工作时,X电极反应为:Fe-2e-=Fe2+ | |
| D. | 原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中 |
20.下表为元素周期表的一部分.X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | X氢化物的沸点一定比Y氢化物的沸点高 | |
| B. | Z的最高价氧化物的水化物酸性一定比W的强 | |
| C. | XZ2、XW4与Na2O的化学键类型相同 | |
| D. | 根据元素周期律,可以推测存在T3Y4、TZ2和TW4 |
17.下列说法不正确的是( )
| A. | 能电离出H+的化合物叫作酸 | |
| B. | 能电离出OH-的化合物不一定是碱 | |
| C. | 电离时生成金属离子和酸根离子的化合物叫作盐 | |
| D. | 酸、碱、盐溶液具有导电性,但溶液呈电中性 |
4.下列反应的离子方程式不正确的是( )
| A. | 钠和水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 氧化钠与水反应:Na2O+H2O═2Na++2OH- | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | Na2CO3溶液与BaCl2溶液反应:CO32-+Ba2+═BaCO3↓ |
20.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
| A. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生 | |
| B. | 向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失 | |
| C. | 向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生 | |
| D. | 向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生 |

 .
.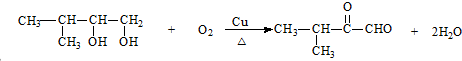 ;F→G:
;F→G: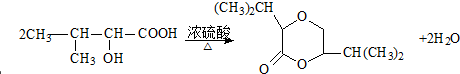 .
.