题目内容
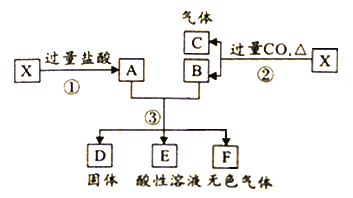
【题目】Ⅰ.白色无机盐 X(含三种元素,相对分子质量小于 400)能与水发生反应。为了探究 X 的组成,设计并完成了以下实验:
已知:白色沉淀 D 中的一种成分及质量与沉淀 B 相同。
(1)白色沉淀 D 的成分为_________(填写化学式)。
(2)黑色固体 A 与浓硝酸反应的离子方程式是_________。
(3)X 与 H2O 反应的化学方程式是_________。
Ⅱ.已知:①将 0.1 mol·Lˉ1KI 溶液加入到 0.1 mol·Lˉ1 FeCl3 溶液中时,可以看到溶液颜色加深,滴加淀粉后溶液变为蓝色;②当离子浓度相同时,氧化性:Ag+>Fe3+;③ 若浓度减小时,离子的氧化性也会随之减弱。
(1)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(事先加入几滴淀粉溶液)加入到 0.1 mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色。请写出该猜测对应的离子方程式_________。实 验结果未见到蓝色。
(2)乙同学认为甲同学的实验方案有问题,理由是_________。请你用原电池的方法证明Ag+也能氧化 Iˉ,要求画出实验装置图,并标明电极材料及电解质溶液 ________。

【答案】BaSO4和AgCl Ag2S+8NO3-+8H+=2Ag ++SO42-+8NO2↑+4H2O Ag2S2O3+H2O=Ag2S+H2SO4 2Ag++2Iˉ=2Ag+I2 Ag+会与Iˉ发生反应生成AgI沉淀,使Ag+的浓度下降,从而减弱Ag+的氧化性,使上述反应很难发生 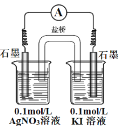
【解析】
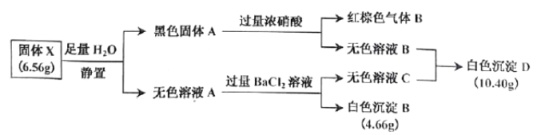
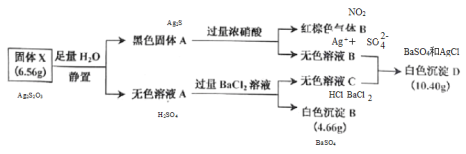
Ⅰ.白色无机盐 X(含三种元素,相对分子质量小于 400)能与水发生反应。白色沉淀 D 中的一种成分及质量与沉淀 B 相同,B为BaSO4,物质的量为![]() ,D中另一种沉淀为与氯离子生成的AgCl,物质的量为
,D中另一种沉淀为与氯离子生成的AgCl,物质的量为![]() ,推知X中含S:0.02mol×2=0.04mol、Ag:0.04mol、由质量守恒含氧
,推知X中含S:0.02mol×2=0.04mol、Ag:0.04mol、由质量守恒含氧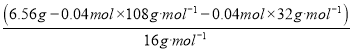 =0.012mol,A的实验式为Ag2S2O3,相对分子质量小于400时,Ag2S2O3为328,符合题意,A为Ag2S2O3,与水反应Ag2S2O3+H2O=Ag2S+H2SO4;黑色固体A为Ag2S,与浓硝酸反应的离子方程式是Ag2S+8NO3-+8H+=2Ag ++SO42-+8NO2↑+4H2O;各物质关系如图:
=0.012mol,A的实验式为Ag2S2O3,相对分子质量小于400时,Ag2S2O3为328,符合题意,A为Ag2S2O3,与水反应Ag2S2O3+H2O=Ag2S+H2SO4;黑色固体A为Ag2S,与浓硝酸反应的离子方程式是Ag2S+8NO3-+8H+=2Ag ++SO42-+8NO2↑+4H2O;各物质关系如图:
 ;
;
Ⅱ.Ag+会与Iˉ发生反应生成AgI沉淀,使Ag+的浓度下降,从而减弱Ag+的氧化性,使上述反应很难发生;用原电池的方法证明Ag+也能氧化 Iˉ,要用盐桥将Ag+和I-分开,用惰性电极作电极,由此设计。
Ⅰ.由(1)白色沉淀 D 的成分为BaSO4和AgCl;
故答案为:BaSO4和AgCl;
(2)黑色固体 A 与浓硝酸反应生成硫酸银和二氧化氮,离子方程式是Ag2S+8NO3-+8H+=2Ag ++SO42-+8NO2↑+4H2O;
故答案为:Ag2S+8NO3-+8H+=2Ag ++SO42-+8NO2↑+4H2O;
(3)X 与 H2O 反应生成黑色的硫化银和硫酸,化学方程式是 Ag2S2O3+H2O=Ag2S+H2SO4;
故答案为:Ag2S2O3+H2O=Ag2S+H2SO4;
Ⅱ.(1)甲同学猜测,0.1 mol·Lˉ1 KI 溶液(事先加入几滴淀粉溶液)加入到0.1mol·Lˉ1AgNO3 溶液中时,溶液应变蓝色,有碘生成,对应的离子方程式2Ag++2Iˉ=2Ag+I2;
故答案为:2Ag++2Iˉ=2Ag+I2 ;
(2)乙同学认为甲同学的实验方案有问题,理由是Ag+会与Iˉ发生反应生成AgI沉淀,使Ag+的浓度下降,从而减弱Ag+的氧化性,使上述反应很难发生。用原电池的方法证明Ag+也能氧化 Iˉ,要用盐桥将Ag+和I-分开,用惰性电极作电极,电极材料及电解质溶液、实验装置图,如图: 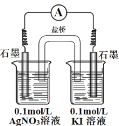 。
。
故答案为:Ag+会与Iˉ发生反应生成AgI沉淀,使Ag+的浓度下降,从而减弱Ag+的氧化性,使上述反应很难发生; 。
。

【题目】物质分类是基本的化学思路。下表是几种常见物质的分类情况:
单质 | 氧化物 | 酸 | 碱 | 盐 |
Mg、S、C、N2 | CaO、CO2 | HCl、H3BO3 | KOH、NH3 H2O | KNO3、K2S |
回答下列问题
(1)下列物质可导电的是_____________;是电解质的是_______________。
①HCl(液态) ②HCl(稀溶液) ③KOH(固体) ④KOH(熔融状态) ⑤KOH(稀溶液)
(2)从上表选择两种物质,发生反应属于化合反应但不属于氧化还原反应,该反应的化学方程式为_____________。(任写一个即可)
(3)点燃时,镁可以在氮气中燃烧,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目__________________。
(4)酸按不同标准分类得到的结果是不同的。已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3属于_____元酸,其电离方程式为______。
(5)黑火药是我国古代伟大的科学发明,反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,若生成22.4L N2(标准状况下),则被氧化的C是_________mol。
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |

实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。

回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。

(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)