��Ŀ����
����Ŀ��I.ij�βɼ�������Ʒ��ÿ��һ��ʱ��ⶨһ��pH���õ��������£�
ʱ�� | ��ʼ | 8Сʱ | 16Сʱ | 24Сʱ | 32Сʱ | 40Сʱ | 48Сʱ |
pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(1)����ʱ����ˮ��Ʒ����_______________�����ǿ���������������䡱����
���Ա仯��ԭ��_________________________________���û�ѧ����ʽ��ʾ����
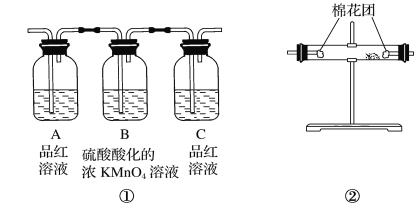
II.����β��(�������ࡢCO��SO2��NO������)�dz��п�������ȾԴ��ұ���ķ���֮һ������������������װһ������ת������(�ò����ٺϽ�������)�������ص���ʹCO��NO��Ӧ�����ɿɲ��������̬����ѭ���������壬����ʹ������ȼ�ռ�SO2��ת����
(2) д��һ����̼��һ��������Ӧ�Ļ�ѧ����ʽ��__________________________��
(3) �ڡ���ת������ת�������������CO2��SO2�����в��ܼ������������������____��
A.KMnO4��Һ B.ʯ��ˮ C.BaCl2��Һ D.Ʒ����Һ
(4) ��Ч���ٳ�����Ⱦ�ķ���������____________
A. ��������Դ B. ʹ�õ綯�� C. ֲ������ D. ���Ϻ������
���𰸡� ��ǿ 2SO2��2H2O��O2= 2H2SO4��2H2SO3��O2==2H2SO4 2CO��2NO![]() 2CO2��N2 BC ABC
2CO2��N2 BC ABC
��������(1)������Ʒ���ã�������ǿ��ԭ���Ƿ��ù����У����귢���ķ�ӦΪ2H2SO3+O2=2H2SO4��������Ʒ�е�H2SO3��������H2SO4��ʹ��Һ��������ǿ��
(2)�ڴ������£�һ��������һ����̼��Ӧ���ɶ�����̼�͵���������ʽΪ��2NO+2CO![]() 2CO2+N2��
2CO2+N2��
(3)A��KMnO4��Һ����CO2��Ӧ������SO2��Ӧ��5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4�����Լ��𣬹�A����B��SO2��CO2����ʹ�����ʯ��ˮ����ǣ�������ͬ�������𣬹�B��ȷ��C��������̼��SO2������ʹBaCl2��Һ ����ǣ������Լ��𣬹�C��ȷ��D�������������Ư������ʹƷ����ɫ����������̼����ʹƷ����ɫ������Լ��𣬹�D����ѡBC��
(4)A������ȼ�յIJ�����ˮ���Ի���������Ⱦ�ģ��ܿ��Ƴ��п�����ȾԴ����A��ȷ��B��ʹ�õ綯������������Կ�������Ⱦ�����ʣ��ܿ��Ƴ��п�����ȾԴ����B��ȷ��C��ֲ�����ֿ��Ծ���������������������C��ȷ��D������������ڿ������м���Σ�յIJ�������Ⱦ��������ģ�ƽʱ���������Dz��˴��ģ����Ǵ�Դͷ�Ͽ��ƿ�����ȾԴ����D����ѡABC��

����Ŀ��700��ʱ��H2��g����CO2��g��![]() H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
H2O��g����CO��g�������¶��£��ڼס��ҡ������������ܱ������У�Ͷ��H2��CO2����ʼŨ�����±���ʾ�����м�2min��ƽ��ʱ��v (H2O)Ϊ0.025 mol/��L��min���������жϲ���ȷ���ǣ� ��
��ʼŨ�� | �� | �� | �� |
C��H2��/mol/L | 0.1 | 0.2 | 0.2 |
C��CO2��/mol/L | 0.1 | 0.1 | 0.2 |
A��ƽ��ʱ������CO2��ת���ʴ���50��
B������Ӧƽ��ʱ������c��CO2���Ǽ��е�2��
C���¶�����800����������Ӧƽ�ⳣ��Ϊ25/16��������ӦΪ���ȷ�Ӧ
D�������������䣬����ʼʱ���������г���0.10mol/L H2��0.20 mol/L CO2������ƽ��ʱc (CO)���Ҳ�ͬ