题目内容
【题目】铝是一种很重要的金属,可以发生一系列反应制备物质. 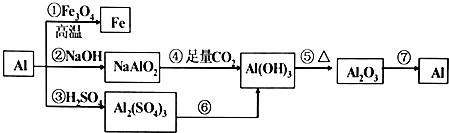
回答下列问题:
(1)反应①可以用于(说出一条).
(2)②③反应产生等量氢气消耗的NaOH与H2SO4的物质的量之比为 .
(3)反应④的离子反应的方程式为 .
(4)用反应⑥制备Al(OH)3 , 最好是向A12(SO4)3溶液中滴加 , 离子方程式为 .
(5)工业上常用反应⑦制备金属铝,制备过程的方程式是 .
【答案】
(1)焊接铁轨或冶炼金属
(2)2:3
(3)AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣
(4)氨水;Al3++3NH3?H2O=Al(OH)3↓+3NH4+
(5)2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
【解析】解:(1)金属铝和一些金属的氧化物如氧化铁在高温下的置换反应称为铝热反应,生成的铁是液态,可以用来焊接钢轨,所以答案是:焊接铁轨或冶炼金属;
·(2)令生成的氢气的物质的量为3mol,则:
2Al+3H2SO4=Al2(SO4)3+3H2↑
3mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
稀硫酸和氢氧化钠溶液的物质的量浓度相等,所以所取稀硫酸和氢氧化钠溶液的体积比等于溶质H2SO4、NaOH的物质的量的之比,即为3mol:2mol=3:2,NaOH与H2SO4的物质的量之比为2:3;所以答案是:2:3;(3)反应④是偏铝酸根离子与二氧化碳气体反应生成氢氧化铝和碳酸氢根离子,其离子反应的方程式为AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣ , 所以答案是:AlO2﹣+CO2+2H2O=Al(OH)3↓+HCO3﹣;(4)氢氧化铝是两性氢氧化物,只能和强酸强碱反应,不与弱酸弱碱反应,故实验室制备氢氧化铝时一般用弱碱而不用强碱,故实验室制取Al(OH)3的化学方程式为:AlCl3+3NH3H2O=Al(OH)3↓+3NH4Cl,离子方程式为:Al3++3NH3H2O=Al(OH)3↓+3NH4+;所以答案是:氨水;Al3++3NH3H2O=Al(OH)3↓+3NH4+;(5)电解熔融的氧化铝得到单质铝和氧气,化学方程式为:2Al2O3(熔融) ![]() 4Al+3O2↑,所以答案是:2Al2O3(熔融)
4Al+3O2↑,所以答案是:2Al2O3(熔融) ![]() 4Al+3O2↑.
4Al+3O2↑.
【考点精析】关于本题考查的铝的化学性质,需要了解很快与O2反应,形成致密氧化膜,抗腐蚀性比镁强;在纯氧中或高温下可燃烧;与沸水只有微弱反应才能得出正确答案.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
