题目内容
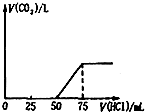
【题目】实验室有一份含有杂质MgCl2和KCl的AlCl3溶液M,某小组用下图所示过程对其进行除杂并尽可能的减少AlCl3的损失。请回答下列问题:
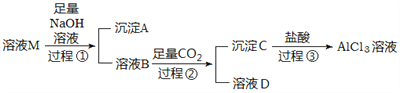
(1)沉淀A的化学式为__________,过程①中Al3+发生反应的离子方程式为__________________。
(2)氢氧化钠溶液_____(填“能”或“不能”)用氨水代替,原因是_____________________。
(3)溶液B中大量存在的阳离子是______________,过程②中生成沉淀C的离子方程式为_____________________________。
【答案】 Mg(OH)2 Al3++4OH- = AlO2-+2H2O 不能 因为在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开 K+、Na+ AlO2-+2H2O+CO2 = Al(OH)3↓+HCO3-
【解析】向含有杂质MgCl2和KCl的AlCl3溶液M中加入足量的NaOH溶液,Mg2+反应生成Mg(OH)2沉淀,Al3+反应生成AlO2-,则沉淀A为Mg(OH)2,溶液B中含有K+、Na+、AlO2-、OH-、Cl-,向溶液B中通入足量的CO2,AlO2-发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成Al(OH)3沉淀,则沉淀C为Al(OH)3,Al(OH)3与盐酸反应生成AlCl3。
(1).根据上述分析可知,沉淀A的化学式为Mg(OH)2,过程①中Al3+与足量的NaOH反应的离子方程式为:Al3++4OH- = AlO2-+2H2O,故答案为:Mg(OH)2;Al3++4OH- = AlO2-+2H2O;
(2).氢氧化钠溶液不能用氨水代替,原因是在Al3+与氨水反应生成Al(OH)3后,氨水是弱碱,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开,故答案为:在Al3+与氨水反应生成Al(OH)3后,Al(OH)3不能与氨水继续反应,从而不能将Al(OH)3与Mg(OH)2分开;
(3)根据上述分析可知,在溶液B中大量存在的阳离子是K+、Na+,过程②中AlO2-与CO2和H2O发生反应AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,生成Al(OH)3沉淀,故答案为:K+、Na+;AlO2-+2H2O+CO2 = Al(OH)3↓+HCO3-。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案