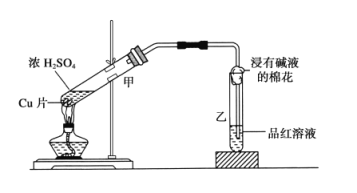
题目内容
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ·mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
2N2(g)+6H2O (l) ΔH=- 1530.6 kJ·mol-1。
合成氨反应的热化学方程式为_____________________________。
(2)恒温恒容条件下,起始按物质的量之比为1∶1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_______________;然后只降低温度,N2(g)的体积分数会_________(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃时,CO2(g)和NH3(g)合成尿素的原理为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
CO(NH2)2(s)+H2O(1)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2 mol·L-1。
①0~2min内,用NH3表示的反应速率υ(NH3)=___________;反应的平衡常数K=____________。
②若其他条件不变,2 min时将容器体积迅速压缩到1L,在3 min时重新达到平衡,请在图1中画出2~3 min内c(NH3)随时间(t)变化的曲线关系图。

(4)碱性氨气燃料电池的装置如图2 所示,写出负极的电极反应式____________________。当电路中每通过3.6 mol e-,则需要标况下空气的体积________________L。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) △H=-92.7 kJmol-1 50% C 0.2 mol·L-1·min-1 250
2NH3(g) △H=-92.7 kJmol-1 50% C 0.2 mol·L-1·min-1 250  2NH3-6e-+6OH-=N2+6H2O 100.8
2NH3-6e-+6OH-=N2+6H2O 100.8
【解析】(1)根据H2的燃烧热写出H2燃烧的热化学方程式,再用盖斯定律。
(2)用三段式计算平衡后N2(g)的体积分数。降低温度,平衡向正反应方向移动,N2(g)物质的量减小,气体总物质的量也减小,结合计算判断N2(g)的体积分数。
(3)①根据化学反应速率的含义计算υ(NH3)。用三段式和化学平衡常数表达式计算K。
②其他条件不变时,将容器体积迅速压缩到1L,NH3(g)、CO2(g)迅速增大到平衡时的两倍;增大压强平衡向正反应方向移动,NH3(g)、CO2(g)浓度又减小,再依据化学平衡常数计算3min平衡时c(NH3)。
(4)根据装置图中电子的流向,通入NH3的一极为负极,通入O2的一极为正极;NH3失电子被氧化成N2,结合碱性条件、原子守恒和电荷守恒写电极反应式,根据电极反应式计算消耗标准状况下空气的体积。
(1)氢气的燃烧热为286.0kJ/mol,H2燃烧的热化学方程式为H2(g)+![]() O2(g)=H2O(l)ΔH=-286.0kJ/mol(i)
O2(g)=H2O(l)ΔH=-286.0kJ/mol(i)
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(l) ΔH=- 1530.6 kJ/mol(ii)
2N2(g)+6H2O(l) ΔH=- 1530.6 kJ/mol(ii)
应用盖斯定律,将[(i)![]() 6-(ii)]
6-(ii)]![]() 2得,N2(g)+3H2(g)
2得,N2(g)+3H2(g)![]() 2NH3(g)ΔH=[(-286.0kJ/mol)
2NH3(g)ΔH=[(-286.0kJ/mol)![]() 6-(-1530.6kJ/mol)]
6-(-1530.6kJ/mol)]![]() 2=-92.7kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g)
2=-92.7kJ/mol,合成氨反应的热化学方程式为N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.7kJ/mol。
2NH3(g)ΔH=-92.7kJ/mol。
(2)设起始N2、H2物质的量都为amol,从起始到平衡过程中转化N2物质的量为xmol,用三段式
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
n(起始)(mol) a a 0
n(转化)(mol) x 3x 2x
n(平衡)(mol)a-x a-3x 2x
达平衡后,N2(g)的体积分数为![]() 100%=
100%=![]() 100%=50%。
100%=50%。
降低温度,平衡向正反应方向移动,N2(g)物质的量减小,气体总物质的量也减小,根据上述计算,N2(g)的体积分数与a、x无关,恒为50%,即N2(g)的体积分数不变,答案选C。
(3)①υ(NH3)=![]() =
=![]()
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
c(起始)(mol/L) 0.6 0.3
c(转化)(mol/L) 0.4 0.2
c(平衡)(mol/L) 0.2 0.1
反应的平衡常数K=![]() =
=![]() =250。
=250。
②其他条件不变时,将容器体积迅速压缩到1L,NH3(g)、CO2(g)迅速增大到平衡时的两倍,瞬时NH3(g)、CO2(g)的浓度依次为0.4mol/L、0.2mol/L;增大压强平衡向正反应方向移动,NH3(g)、CO2(g)浓度又减小,设3min平衡时c(NH3)=ymol/L,用三段式
2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
2min体积压缩至1L时(mol/L) 0.4 0.2
2~3min内c(转化)(mol/L) 0.4-y ![]()
3min时c(平衡)(mol/L) y ![]()
温度不变,化学平衡常数不变,K=![]() =
=![]() =250,解得y=0.2。作图要点:2min时c(NH3)为0.4mol/L,2~3min内c(NH3)逐渐减小,3min时达到平衡c(NH3)=0.2mol/L。
=250,解得y=0.2。作图要点:2min时c(NH3)为0.4mol/L,2~3min内c(NH3)逐渐减小,3min时达到平衡c(NH3)=0.2mol/L。
(4)根据装置图中电子的流向,通入NH3的一极为负极,通入O2的一极为正极,NH3失电子生成N2,2molNH3失去6mol电子生成1molN2,结合碱性条件、原子守恒和电荷守恒,负极电极反应式为2NH3-6e-+6OH-=N2+6H2O。正极电极反应式为O2+4e-+2H2O=4OH-,当电路中通过3.6mole-时,消耗O2物质的量为0.9mol,消耗标准状况下O2的体积为0.9mol![]() 22.4L/mol=20.16L,需要标准状况下空气的体积为20.16L
22.4L/mol=20.16L,需要标准状况下空气的体积为20.16L![]() 0.2=100.8L。
0.2=100.8L。

【题目】部分弱酸的电离平衡常数如表:
(1)室温下①0.1 mol·L-1 HCOONa,②0.1 mol·L-1 NaClO,③0.1 mol·L-1 Na2CO3,④0.1 mol·L-1
NaHCO3溶液的pH由大到小的关系为_____________________________________。
(2)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度由大到小的顺序为___________________________________。
浓度由大到小的顺序为___________________________________。
(3)下列离子方程式正确的是________(填字母)。
a.2ClO-+H2O+CO2===2HClO+CO![]() b.2HCOOH+CO
b.2HCOOH+CO![]() ===2HCOO-+H2O+CO2↑
===2HCOO-+H2O+CO2↑
c.H2SO3+2HCOO-===2HCOOH+SO![]() d.Cl2+H2O+2CO
d.Cl2+H2O+2CO![]() ===2HCO
===2HCO![]() +Cl-+ClO-
+Cl-+ClO-
(4)某温度(T ℃)下的溶液中,c(H+)=10-xmol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示.

① 此温度下,0.01mol/L的NaOH溶液中水电离出的OH-浓度为_____。
②在此温度下,0.1 mol·L-1的NaHSO4溶液与0.1 mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol·L-1NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
按丁方式混合后,所得溶液显________(填“酸”“碱”或“中”)性.写出按乙方式混合后,反应的离子方程式:__________________________。按甲方式混合后,所得溶液的pH为________。