题目内容
【题目】(1)研究氯气跟金属的反应时,选用金属铜进行实验。用坩埚钳夹住一束铜丝,灼热后立刻放入充满氯气的集气瓶里。铜丝燃烧后把少量水注入集气瓶里,用玻璃片盖住瓶口,振荡。
①根据哪些实验现象可判断铜丝燃烧后生成了+2价铜的化合物:_______________。
②反应的化学方程式为______________________________________________________。
(2)研究浓硫酸的强氧化性时,选用金属铜跟浓硫酸进行实验,实验装置如下图所示。
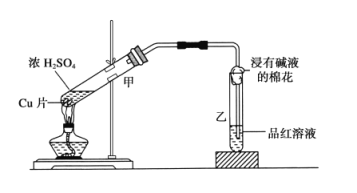
①乙中的现象_______,试管中的浸有碱液的棉花的作用是____________。
②甲中的反应方程式为_____________________________________。
(3)上述两个实验为什么都选金属铜作样本来进行实验________。
A.铜是一种不活泼金属
B.选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况
C.铜是一种常见金属
D.铜跟氯气或浓硫酸反应可生成有色溶液,现象明显
【答案】燃烧时产生棕色烟,加水振荡后得到蓝绿色溶液 ② Cu+Cl2![]() CuCl2 品红溶液褪色 防止SO2逸出污染空气 Cu+2H2SO4(浓)
CuCl2 品红溶液褪色 防止SO2逸出污染空气 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O ABCD
CuSO4+SO2↑+2H2O ABCD
【解析】
(1)①根据铜与氯气的反应现象及生成固体溶于水后溶液变成蓝色分析;
②铜与氯气在点燃条件下反应生成氯化铜;
(2)①二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫为污染气体,需要用氢氧化钠溶液吸收多余的二氧化硫;
②甲中铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水;
(3)根据铜为常见金属且性质不活泼,与氯气、浓硫酸反应后生成物溶于水形成有色溶液等方面考虑。
(1)①铜在氯气中燃烧的现象为:铜丝剧烈燃烧,产生大量棕黄色的烟,加水后形成了蓝绿色溶液,证明反应生成了+2价的铜,
故答案为:燃烧时产生棕色烟,加水振荡后得到蓝绿色溶液。
②铜与氯气反应生成氯化铜,反应的化学方程式为:Cu+Cl2![]() CuCl2,
CuCl2,
故答案为:Cu+Cl2![]() CuCl2。
CuCl2。
(2)①二氧化硫具有漂白性,能使品红溶液褪色;二氧化硫有毒,多余的气体不能直接排放,需要用氢氧化钠溶液吸收SO2气体,防止空气污染,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:品红溶液褪色;防止SO2逸出污染空气。
②甲中铜与浓硫酸在加热条件下反应生成二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(3)由于铜是一种不活泼金属,选用铜作实验可以推测更多金属跟氯气或浓硫酸反应的情况,铜又是一种常见金属及铜跟氯气或浓硫酸反应可生成有色溶液,现象明显,所以选金属铜作样本来进行实验,故A、B、C、D正确。
故答案为:ABCD。

【题目】图用分类法表示了一些物质或概念之间的从属或包含关系,不正确的是( )
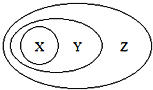
X | Y | Z | |
A | NaAlO2 | 盐 | 纯净物 |
B | 胶体 | 分散系 | 混合物 |
C | Al2O3 | 两性氧化物 | 氧化物 |
D | 单质参与反应 | 置换反应 | 氧化还原反应 |
A. A B. B C. C D. D









