题目内容
25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH)
D.pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
D
解析试题分析:HA溶液与MOH溶液任意比混合,不论HA是强酸还是弱酸,混合后溶液中的离子就只有H+、M+、OH-、A- ,所以一定满足电荷守恒c(H+) + c(M+)=c(OH-) + c(A-),A正确;B项满足质子守恒c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3 ,B正确;醋酸钠、盐酸两溶液混合后含有的离子有Na+、H+ 、Cl—、OH- 、CH3COO- ,满足电荷守恒c(H+) + c(Na+)=c(OH-) + c(CH3COO-) + c(Cl—),由于溶液呈中性,c(H+) =c(OH-),则c(Na+)= c(CH3COO-) + c(Cl—),又因为加入的醋酸钠满足物料守恒c(Na+)=c(CH3COOH)+ c(CH3COO-),所以c(CH3COOH)+ c(CH3COO-)= c(CH3COO-) + c(Cl—),得出c(CH3COOH) = c(Cl—),所以C正确;NaHA的可以是强酸的酸式盐也可以是弱酸酸式盐,所以D错误,选D。
考点:本题考查的是溶液中离子浓度大小比较。

常温下,下列离子能使纯水中的H+离子数目增加的是
| A.NH4+ | B.CO32- | C.S2- | D.Na+ |
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述正确的是
| A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
| B.NaHCO3溶液中:c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| C.中和体积与物质的量浓度都相同的HCl溶液和CH3COOH溶液消耗NaOH物质的量相同 |
| D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗NaOH物质的量相同 |
25℃时,某溶液中由水电离产生的c(H+)和c(OH—)的乘积为1×10-20,下列说法正确的是
| A.该溶液的pH一定是10 | B.该溶液不可能pH=4 |
| C.该溶液的pH不可能是7 | D.不会有这样的溶液 |
在相同温度下,100 mL0.01 mol·L-1的醋酸溶液与10 mL0.1 mol·L-1的醋酸溶液相比较,下列数值前者大于后者的是
| A.中和时所需NaOH的量 | B.电离的程度 |
| C.H+的物质的量浓度 | D.CH3COOH的物质的量 |
已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-12mol·L-1 |
| C.加入NaHSO4晶体抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液后溶液呈碱性 |
常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是( )

图1 图2
| A.图2是滴定盐酸的曲线 |
| B.a与b的关系是:a<b |
| C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)> c(Na+)> c(H+)> c(OH-) |
| D.这两次滴定都可以用甲基橙作为指示剂 |
水的电离平衡曲线如图所示,下列说法不正确的是( )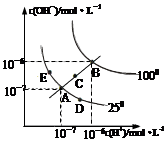
| A.图中五点KW间的关系:B>C>A=D=E |
| B.若从A点到D点,可采用:温度不变在水中加入少量的酸 |
| C.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性 |
| D.若从A点到C点,可采用:温度不变在水中加入适量的NH4Cl固体 |