题目内容
20.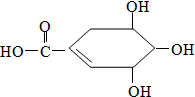 防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )
防治禽流感病毒是目前人类面临的一个重大课题.八角茴香属于草本植物,是我国民间常用做烹调的香料.医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体.莽草酸的结构式如图所示,下列关于莽草酸的说法正确的是( )| A. | 莽草酸的分子之间不能发生酯化反应 | |
| B. | 莽草酸的分子式为C7H10O5 | |
| C. | 莽草酸中含有苯环 | |
| D. | 莽草酸不能使溴水褪色 |
分析 该物质中含有碳碳双键、羧基和醇羟基,具有烯烃、醇和羧酸的性质,能发生加成反应、酯化反应、消去反应、氧化反应等,据此分析解答.
解答 解:A.该分子中含有醇羟基和羧基,所以分子之间可以发生酯化反应,故A错误;
B.根据图片及原子成键方式知,该分子的分子式为C7H10O5,故B正确;
C.该分子中有环状结构但不含苯环,故C错误;
D.该物质中含有碳碳双键,所以能和溴发生加成反应而使溴水褪色,故D错误;
故选B.
点评 本题考查有机物结构和性质,为高考高频点,明确有机物中官能团及其性质即可解答,熟练常见有机物官能团、反应条件及断键和成键方式,注意并不是所有的醇都能发生消去反应,为易错点.

练习册系列答案
相关题目
10.溴有两种同位素,在自然界中这两种同位素大约各占一半,已知溴的原子序数是35,原子量是80,则溴的两种同位素的中子数分别等于( )
| A. | 79、81 | B. | 45、46 | C. | 44、45 | D. | 44、46 |
11.将一定量的锌与100mL 18.5mol/L浓硫酸充分反应后,锌完全溶解,同时生成气体A为33.6L(标准状况).将反应后的溶液稀释至1L,测得溶液的c(H+)=0.1mol•L-1,则下列叙述中错误的是( )
| A. | 气体A为SO2和H2的混合物 | B. | 气体A中SO2和H2的体积比为4:1 | ||
| C. | 反应中共消耗Zn 97.5g | D. | 反应中共转移3mol电子 |
8.元素X原子的最外层有6个电子,元素Y原子的最外层有3个电子,这两种元素形成的化合物的化学式可能是( )
| A. | X3Y2 | B. | X2Y | C. | Y3X2 | D. | Y2X3 |
15.已知热化学方程式C2H2(g)+52O2(g)=2CO2(g)+H2O(g);△H=-1256kJ•mol-1,下列正确的是( )
| A. | 乙炔的燃烧热为1256 kJ•mol-1 | |
| B. | 若生成2 mol液态水,则△H=-2512 kJ•mol-1 | |
| C. | 若形成4 mol碳氧共用电子对,则放出的热量为2512 kJ | |
| D. | 若转移10 mol电子,则消耗2.5 mol O2 |
5.下列叙述中不正确的是( )
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| D. | 某一反应体系中的物质有:HC1、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
9.用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为722.4NA | |
| B. | 1mol碳正离子CH5+所含的电子数为10NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
8.常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于( )
| A. | 9.0 | B. | 9.5 | C. | 1 0.5 | D. | 1 1.0 |
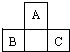 A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则
A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则 ,A的氢化物分子式为H2O;
,A的氢化物分子式为H2O;