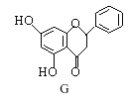
题目内容
【题目】把1 mol X气体和0.5 mol Y气体混合于2 L密闭容器中,发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
nZ(g)+2W(g),2 min末生成0.2 mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol/(L·min),试计算:
(1)前2 min内,用X表示的平均反应速率________;
(2)2 min末时Y的转化率________;
(3)化学方程式中Z的化学计量数n________。
【答案】(6分)
(1)0.075 mol/(L·min) (2)20% (3) 4
【解析】
试题根据三段式解题 3X(g)+Y(g)=nZ(g)+2W(g)
起始浓度(mol/L) 0.5 0.25 0 0
变化浓度(mol/L) 0.15 0.05 0.05n 0.1
平衡浓度(mol/L) 0.35 0.2 0.05n 0.1
(1)根据2 min末生成0.2 mol W ,则X反应掉0.3mol,v(X)=0.3mol÷(2L×2min)=0.075 mol/(L·min)
(2)α(Y)=0.05÷0.25×100%=20%
(3)根据V (Z)=△C÷t=0.05nmol/L÷2min=0.1 mol/(L·min),解得n=4。

【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
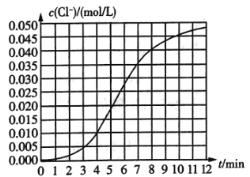
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
【题目】某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
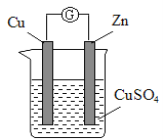
实验 记录 | ① Cu为正极,Zn为负极; ② Zn质量减少,Cu质量增加; ③ SO ④ 电子流方向是:由Zn经导线流入Cu片; ⑤ Zn电极发生还原反应; ⑥ 正极反应式:Cu2+ + 2e- = Cu |
A.②③④ B.①②④⑥ C.①②④⑤ D.②③⑤⑥