题目内容
【题目】某化学兴趣小组欲测定KClO3,溶液与![]() 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和
溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO3,溶液和![]() 溶液,所得数据如图所示。已知:
溶液,所得数据如图所示。已知:![]() 。
。
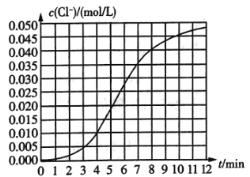
(1)根据实验数据可知,该反应在0~4min内的平均反应速率![]() ________
________![]() 。
。
(2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。
方案 | 假设 | 实验操作 |
Ⅰ | 该反应放热使溶液温度升高,反应速率加快 | 向烧杯中加入10mL0.1mo//L的 |
Ⅱ | 取10mL0.1mo/L的 | |
Ⅲ | 溶液酸性增强加快了化学反应速率 | 分别向a、b两只烧杯中加入10mL0.1mol/L的 |
①补全方案Ⅰ中的实验操作:________。
②方案Ⅱ中的假设为________。
③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。
④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。
⑤反应后期,化学反应速率变慢的原因是________。
【答案】0.0025 插入温度计 生成的![]() 加快了化学反应速率 生成的
加快了化学反应速率 生成的![]() 加快了化学反应速率 将1mL水改为1mL0.2mol/L的NaCl溶液 反应物浓度降低
加快了化学反应速率 将1mL水改为1mL0.2mol/L的NaCl溶液 反应物浓度降低
【解析】
(1)根据实验数据可知,该反应在0~4min内生成氯离子的浓度是0.010mol/L,所以平均反应速率![]() ;
;
(2)①由于是假设该反应放热,使溶液温度升高,反应速率加快,因此需要测量反应过程中溶液温度的变化;
②方案I、Ⅱ相比较,Ⅱ中加入了少量氯化钠,所以方案Ⅱ中的假设为生成的![]() 加快了化学反应速率;
加快了化学反应速率;
③由于反应中还有硫酸根离子生成,则除I、Ⅱ、Ⅲ中的假设外,还可以提出的假设是生成的硫酸根离子加快了化学反应速率;
④为防止氯离子对实验的干扰,则改进措施是将1mL水改为1mL0.2mol/L的NaCl溶液;
⑤反应后期反应物浓度减小,因此化学反应速率变慢。

 目标测试系列答案
目标测试系列答案【题目】如图是某化学兴趣小组制备PCl3的实验装置(部分仪器已省略):
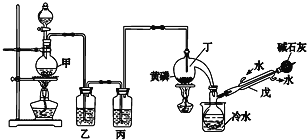
有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 其他 | |
黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
请回答下列问题:
(1)仪器戊的名称为___。
(2)实验时甲中所发生反应的化学方程式为___。
(3)乙中盛放的试剂是___,其作用是___;丙中盛放的试剂是___,其作用是___。
(4)向仪器丁中通入干燥、纯净的Cl2之前,应先通入一段时间的CO2,其目的主要是___。
(5)碱石灰的作用是___(答出一条即可)。
(6)PCl3粗产品中常含有POCl3、PCl5等,加入黄磷(化学式用P表示)经加热除去PCl5的化学反应方程式为___,后通过___(填实验操作名称),即可得到PCl3纯品。