题目内容
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。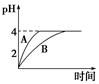
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。
(1)B < (2)5 6 (3)向溶液中加入足量BaCl2(或CaCl2)溶液,如果无白色沉淀生成说明甲正确,有白色沉淀产生说明乙正确
解析

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2 mol·L-1的盐酸进行滴定,完成下列问题:
(1)称取5.0 g该氢氧化钠固体样品,配成500 mL溶液备用。
(2)将标准盐酸装在25.00 mL的________滴定管中,调节液面位置在“0”刻度以下,并记录下刻度。
(3)取20.00 mL待测液。该项实验操作使用的主要仪器有________。用酚酞作指示剂时,滴定到溶液颜色由________色刚好变成________色为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算氢氧化钠的质量分数为________。
(5)试分析上述滴定误差可能由下列哪些实验操作引起________(填序号)。
| A.转移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时反应器摇动太激烈,有少量液体溅出 |
| D.滴定到终点时,滴定管尖嘴悬有气泡 |
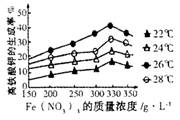
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的四种溶液;a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)。
(2)常温下,0.1mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是 。
A.c(H+ )
B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-)
D.c(OH-)/c(H+)
E.c(H+)·c(CH3COO-)/c(CH3COOH)
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则同温度时HX的电离平衡常数_ ____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是_____________________。

(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)= mol·L-1(填精确值)。
(5)标准状况下,将1.12L CO2通入100mL 0.75mol·L-1的NaOH溶液中,则溶液中离子的浓度由大到小的顺序