题目内容
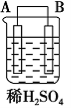
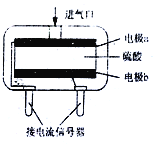
【题目】以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如下图所示。
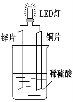
某实验兴趣小组做完实验后,在读书卡片上记录如下:

(1)在卡片上,记录合理的是(填序号)。
(2)其他条件相同情况下,产生气泡的速率比单一锌片(填“快”或“慢”),如果将锌片换成铁片,电路中的电流方向(填“变”或“不变”)。
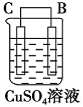
(3)如果把硫酸换成硫酸铜溶液,猜测(填“锌片”或“铜片”)变厚,原因是(用电极方程式表示)。实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为mol。
(4)有同学利用原电池原理,将A、B、C、D四种金属设计成下表中装置进行实验用以判断四种金属的活泼性强弱。
序号 | 甲 | 乙 | 丙 |
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据以上现象,判断四种金属活泼性由强到弱的顺序是。
【答案】
(1)⑤⑥
(2)快;不变
(3)铜片;Cu2++2e-=Cu;0.2;
(4)D>A>B>C;
【解析】
试题分析:(1)锌比铜活泼,形成原电池反应时,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,发生还原反应,电极方程式为2H++2e-═H2↑,由此可知若有1mol电子流经导线,则产生0.5mol氢气,电子由负极经外电路流向正极,原电池中阳离子向正极移动,阴离子向负极移动,则正确的有⑤⑥,故答案为:⑤⑥;
(2)Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,能加快锌与硫酸的反应速率,所以其他条件相同情况下,产生气泡的速率比单一锌片快;故答案为:快;不变
(3)如果把硫酸换成硫酸铜溶液,正极Cu上会有铜单质析出,而变粗,其电极反应为:Cu2++2e-=Cu;则电池总反应为Zn与铜离子的反应,为Cu2++Zn=Zn2++Cu,已知正极:Cu2++2e-=Cu,负极:Zn-2e-=Zn2+,设电路中转移电子的物质的量为n,则正极质量增加32n,负极质量减少32.5n,所以32.5n+32n=12.9g,解得n=0.2mol,故答案为:铜极;Cu2++Zn=Zn2++Cu;0.2;
(4)甲、乙、丙为原电池装置,甲中A不断溶解,说明A被氧化,为原电池负极,B为正极,乙中C的质量增加,说明C极上析出金属,为原电池正极,则B为负极,丙中A上有气体产生,应为氢气,说明A为正极,则D为负极,原电池反应中负极较活泼,则金属的活泼性顺序为D>A>B>C,故答案为:D>A>B>C