题目内容
【题目】一氧化碳被广泛应用于冶金工业和电子工业。
(1)己知CO的燃烧热为283kJ/mol,请写出体现CO燃烧热的热化学方程式___________。
(2)高炉炼铁是最为普遍的炼铁方法,相关反应的热化学方程式如下:
4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol
CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s)△H=bkJ/mol
请写出CO直接将Fe2O3还原为Fe的热化学方程式:____________(用含a,b的代数式表示△H的数值)。
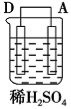
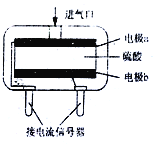
(3)使用电化学一氧化碳气体传感器定量检测空气中CO含量,其结构如右图所示。这种传感器利用燃料电池原理,则该电池的负极反应式为_________。
【答案】 CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol 9CO(g)+3Fe2O3(s)=9CO2(g)+6Fe(s) △H=(2a+b)kJ/mol CO+H2O-2e-=CO2+2H+
【解析】(1)己知CO的燃烧热为283kJ/mol,则CO燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol;(2)已知:①4CO(g)+Fe3O4(s)=4CO2(g)+3Fe(s)△H=akJ/mol,②CO(g)+Fe2O3(s)= CO2(g)+2Fe3O4(s) △H=bkJ/mol,根据盖斯定律可知将“①×![]() +②×
+②×![]() ”即能得3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H=(2a+b)/3 kJ·mol-1。(3)CO在负极上发生氧化反应,据得失电子守恒有CO-2e――CO2,再据电荷守恒有CO-2e――CO2+2H+,最后据原子守恒得CO+H2O-2e-=CO2+2H+。
”即能得3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H=(2a+b)/3 kJ·mol-1。(3)CO在负极上发生氧化反应,据得失电子守恒有CO-2e――CO2,再据电荷守恒有CO-2e――CO2+2H+,最后据原子守恒得CO+H2O-2e-=CO2+2H+。

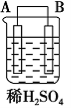
【题目】以Zn和Cu为电极,稀硫酸为电解质溶液形成的原电池,供LED发光,装置如下图所示。
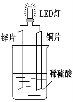
某实验兴趣小组做完实验后,在读书卡片上记录如下:

(1)在卡片上,记录合理的是(填序号)。
(2)其他条件相同情况下,产生气泡的速率比单一锌片(填“快”或“慢”),如果将锌片换成铁片,电路中的电流方向(填“变”或“不变”)。
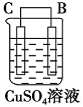
(3)如果把硫酸换成硫酸铜溶液,猜测(填“锌片”或“铜片”)变厚,原因是(用电极方程式表示)。实验结束后称得两极质量差12.9g,假设初始时Zn片与Cu片质量相等,则反应中转移的电子的物质的量为mol。
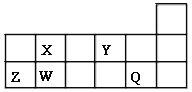
(4)有同学利用原电池原理,将A、B、C、D四种金属设计成下表中装置进行实验用以判断四种金属的活泼性强弱。
序号 | 甲 | 乙 | 丙 |
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据以上现象,判断四种金属活泼性由强到弱的顺序是。
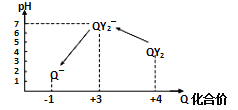
【题目】在密闭容器中有A、B两种物质,在一定的条件下反应:2A(气)+B(固)![]() 2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )
2C(气) △H>0达到平衡后,改变一个条件(X),下列量(Y)一定符合下图中曲线的是( )

X | Y | |
A | 减小压强 | A的转化率 |
B | 升高温度 | 混合气体平均分子量 |
C | 升高温度 | A的浓度 |
D | 增加压强 | B的转化率 |