题目内容
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )
| A.FeCl3(aq)与KSCN(aq)反应的热化学方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) ΔH>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有v(正)>v(逆) |
| D.A点与B点相比,A点的c(Fe3+)大 |
C
解析

 优学名师名题系列答案
优学名师名题系列答案已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)="=" CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s)△H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
| A.-1641.0kJ/mol | B.+3081kJ/mol |
| C.+663.5kJ/mol | D.-2507.0kJ/mol |
下列说法正确的是 ( )。
| A.任何化学反应都伴随着能量的变化 |
| B.H2O(g)―→H2O(l)该过程放出大量的热,所以该过程是化学变化 |
| C.化学反应中能量的变化都表现为热量的变化 |
| D.对于如图所示的过程,是吸收能量的过程 |

某一化学反应在不同条件下的能量变化曲线如下图所示。下列说法正确的是( )
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)ΔH=+489.0 kJ·mol-1①
CO(g)+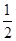 O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
O2(g)=CO2(g)ΔH=-283.0 kJ·mol-1②
C(石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1③
则4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为( )
| A.+1 164.1 kJ·mol-1 | B.-1 641.0 kJ·mol-1 |
| C.-259.7 kJ·mol-1 | D.-519.4 kJ·mol-1 |
已知:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol;②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol。下列结论正确的是( )
| A.碳的燃烧热大于110.5 kJ/mol |
| B.①的反应热为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
有关热化学方程式书写与对应表述均正确的是 ( )。
| A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1 |
| B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1 |
| C.氢气的燃烧热为285.5 kJ·mol-1,则水电解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 |
| D.已知2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·mol-1 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图:
下列叙述正确的是( )。
| A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) ΔH1
2H2(g)+O2(g)=2H2O(g) ΔH2
C(s)+O2(g)=CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为( )。
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |