题目内容
已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)="=" CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s)△H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为( )
| A.-1641.0kJ/mol | B.+3081kJ/mol |
| C.+663.5kJ/mol | D.-2507.0kJ/mol |
A
解析试题分析:根据盖斯定律可得:ΔH=【(①-②)×3+ ③】×2=-1641.0kJ/mol,A、正确。
考点:考查盖斯定律。

练习册系列答案
相关题目
下列图示与对应的叙述相符的是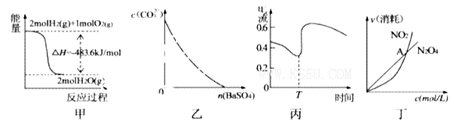
A.图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483. 6kJ |
| B.图乙表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
| C.图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D.图丁表示恒温恒容条件下发生的可逆反应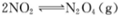 中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
| A.H2O分解为H2与O2时放出热量 |
| B.生成1mol H2O时吸收热量245kJ |
| C.甲、乙、丙中物质所具有的总能量大小关系为乙>甲>丙 |
| D.氢气和氧气的总能量小于水的能量 |
热化学方程式C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
CO(g)+H2(g) ΔH="+131.3" kJ·mol-1表示的
为( )
| A.碳与水反应吸收131.3 kJ的热量 |
| B.1 mol碳和1 mol水反应吸收131.3 kJ的热量 |
| C.1 mol固态碳与1 mol水蒸气反应产生一氧化碳气体和氢气,吸收131.3 kJ的热量 |
| D.固态碳和气态水各1 mol反应,放出131.3 kJ的热量 |
下列说法中错误的是( )
| A.电解饱和食盐水,生成物总能量比反应物总能量高 |
| B.化学反应过程中,发生物质变化的同时一定发生能量变化 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害 |
反应A(g)+B(g)→C(g) ΔH,分两步进行:①A(g)+B(g)―→X(g) ΔH1 ②X(g)―→C(g) ΔH2,反应过程中能量变化如图所示,E1表示A+B―→X的活化能,下列说法正确的是( )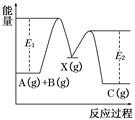
| A.ΔH1=ΔH-ΔH2>0 |
| B.X是反应A(g)+B(g)―→C(g)的催化剂 |
| C.E2是反应②的活化能 |
| D.ΔH=E1-E2 |
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是( )
| A.FeCl3(aq)与KSCN(aq)反应的热化学方程式为:Fe3+(aq)+SCN-(aq)=Fe(SCN)2+(aq) ΔH>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有v(正)>v(逆) |
| D.A点与B点相比,A点的c(Fe3+)大 |
下列说法正确的是( )。
A.反应A(g)  2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 2B(g) ΔH,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ·mol-1,则ΔH=(Ea-Eb) kJ·mol-1 |
| B.标准状况下,向0.1 mol·L-1的氨水中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) |
| C.足量的锌铜合金与100 mL pH=1稀硫酸反应,反应3 s时测得pH=2,假设反应前后溶液的体积保持不变,则3 s内产生氢气的平均速率是33.6 mL·s-1 |
D.将浓度为0.1 mol·L-1 HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,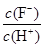 始终保持增大 始终保持增大 |
