题目内容
【题目】第三代混合动力车,可以用电动机、内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态,其电路工作原理如图所示。下列说法中正确的是
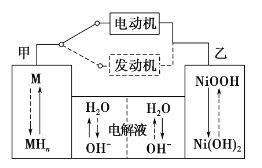
A.放电时甲为负极,充电时为阳极
B.放电时负极的电极反应式为:MHn-ne-=M+nH+
C.电池充电时,OH-由甲侧向乙侧移动
D.汽车下坡时发生图中实线所示的过程
【答案】C
【解析】
根据题干结合电路工作原理分析可知,当汽车上坡或加速时,电动机提供推力,此时电池放电,为原电池,乙电极NiOOH转化为Ni(OH)2,Ni的化合价降低,得到电子作正极,电极反应式为NiOOH+H2O+e-=Ni(OH)2+OH-,则甲为负极,H2失去电子与OH-结合生成H2O,电极反应式为H2-2e-+2OH-=2H2O,当汽车刹车或下坡时,发动机工作,处于充电状态,为电解池,则甲为阴极,乙为阳极,据此分析解答。
A.根据上述分析可知,放电时甲是负极,充电时甲为阴极,故A错误;
B.放电时负极的电极反应式为H2-2e-+2OH-=2H2O,故B错误;
C.电池充电时是电解池的工作原理,其中甲电极是阴极,乙是阳极,电解池中阴离子向阳极移动,所以OH-由甲侧向乙侧移动,故C正确;
D.汽车下坡时发动机在工作,发生图中虚线所示的过程,故D错误;
故答案为C。

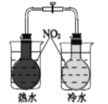
【题目】一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 3 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
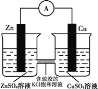
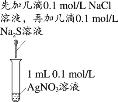
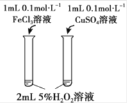
【题目】下列实验方案中,不能达到相应实验目的的是
选项 | A | B | C | D |
实验方案 |
|
|
|
|
目的 | 研究温度对化学平衡的影响 | 验证锌与硫酸铜反应过程中有电子转移 | 证明溶解度:AgCl>Ag2S | 比较不同催化剂对化学反应速率的影响 |
A.AB.BC.CD.D