题目内容
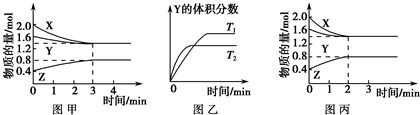
T℃时在2L的密闭容器中X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图乙所示.
则下列结论正确的是( )

则下列结论正确的是( )
| A、该反应可表示为3X(g)+Y(g)?Z(g) | B、若其他条件不变,升高温度,平衡将向逆反应方向移动 | C、若其他条件不变,使用适当的催化剂,则反应可以按图丙进行 | D、若其他条件不变,开始时将该容器压缩为1 L,则反应将按图丙进行 |
分析:A、根据物质的量的变化量与化学计量数成正比书写化学方程式;
B、根据图乙中曲线的转折点判断,T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动;
C、加入催化剂,反应速率增大,平衡所用的时间较短,但平衡状态不发生改变;
D、加压平衡右移,平衡状态会发生改变.
B、根据图乙中曲线的转折点判断,T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动;
C、加入催化剂,反应速率增大,平衡所用的时间较短,但平衡状态不发生改变;
D、加压平衡右移,平衡状态会发生改变.
解答:解:A、根据图1分析,反应中X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,所以X、Y为反应物,Z为生成物,根据物质的量的变化量与化学计量数成正比可知0.4mol:0.2mol:0.4mol=2:1:2,所以反应的化学方程式为2X(g)+Y(g)?2Z(g),故A错误;
B、根据温度越高反应速率越大,达到平衡状态的时间短,根据图乙中曲线的转折点判断,T2时先到达平衡状态,说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,故B错误;
C、图丙与图甲比较,图丙到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故C正确;
D、若其他条件不变,开始时将该容器压缩为1 L,加压平衡右移,平衡状态会发生改变,故D错误.
故选C.
B、根据温度越高反应速率越大,达到平衡状态的时间短,根据图乙中曲线的转折点判断,T2时先到达平衡状态,说明T2温度高,温度升高时Y的百分含量降低,说明平衡向正反应方向移动,故B错误;
C、图丙与图甲比较,图丙到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故C正确;
D、若其他条件不变,开始时将该容器压缩为1 L,加压平衡右移,平衡状态会发生改变,故D错误.
故选C.
点评:本题考查化学平衡移动以及平衡图象题,做题时注意分析图象中曲线的变化规律,结合外界条件对平衡移动的影响进行分析,题目难度中等.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目