题目内容
(2013?莱芜一模)“低碳循环”已引起各国家的高度重视,而如何降低大气中CO2的含量和有效地开发利用CO2正成为化学家研究的主要课题.
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
V正
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01
mol?L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:
5
5
C+4
4
KMnO4+6
6
H2SO4→5
5
CO2↑+4
4
MnSO4+2
2
K2SO4+6
6
H2O(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
0.17
0.17
.②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b 的值
小于1
小于1
(填具体值或取值范围).③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时
V正
<
<
V逆(填“<”,“>”,“=”).(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol
CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol
(4)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.常温下,向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01
mol?L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
;(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为1×10-4mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
1.12×10-4
1.12×10-4
mol/L.分析:(1)反应中C→CO2,碳元素化合价由0价升高为+4价,共升高4价,KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为20,故C的系数为5,故KMnO4系数为4,据此结合原子守恒配平其它物质的系数;
(2)①、根据三段式计算平衡时各组分的物质的量,反应前后气体的化学计量数不变,利用物质的量代替浓度代入平衡常数表达式计算;
②、由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等,要使CO转化率大于H2的转化率,则增大H2的物质的量;
③、计算常数的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(4)向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,溶液中是水电离生成氢离子,据此来确定离子浓度的大小;
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=5×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
(2)①、根据三段式计算平衡时各组分的物质的量,反应前后气体的化学计量数不变,利用物质的量代替浓度代入平衡常数表达式计算;
②、由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等,要使CO转化率大于H2的转化率,则增大H2的物质的量;
③、计算常数的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
(3)根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减构造目标方程式,反应热也乘以相应的系数并进行相应的计算;
(4)向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,溶液中是水电离生成氢离子,据此来确定离子浓度的大小;
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=5×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍.
解答:解:(1)反应中C→CO2,碳元素化合价由0价升高为+4价,共升高4价,KMnO4→MnSO4,Mn元素化合价由+7价降低为+2价,共降低5价,化合价升降最小公倍数为20,故C的系数为5,故KMnO4系数为4,结合原子守恒配平后方程式为:5C+4KMnO4+6H2SO4=5CO2↑+4MnSO4+2K2SO4+6H2O
故答案为:5、4、6=5、4、2、6;
(2)①、平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
=0.17,
故答案为:0.17;
②、由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b的值小于1,
故答案为:小于1;
③、由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=
=1,大于平衡常数0.17,故反应向逆反应进行,所以V正<V逆,
故答案为:<;
(3))①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
即CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,在该溶液中,直接电离出的Na+和HC2O4-浓度最大,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,所以c(Na+)>c(HC2O4-),c(H+)>c(OH-),溶液中水电离生成氢离子,故c(H+)>c(C2O42-),溶液呈酸,电离产生的c(C2O42-)原大于c(OH-),溶液中离子浓度c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=
×1×10-4mol/L=5×10-5mol/L,根据Ksp=c(CO32-)?c(Ca2+)=2.8×10-9可知,钙离子最小浓度c(Ca2+)=
mol/L=5.6×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×5.6×10-5mol/L=1.12×10-4mol/L,
故答案为:1.12×10-4.
故答案为:5、4、6=5、4、2、6;
(2)①、平衡时CO的物质的量为1.6mol,则:
CO(g)+H2O(g)?CO2(g)+H2(g),
开始(mol):2 1 0 0
变化(mol):0.4 0.4 0.4 0.4
平衡(mol):1.6 0.6 0.4 0.4
该反应前后气体体积不变,故利用物质的量代替浓度计算平衡常数,故900℃时该反应平衡常数k=
| 0.4×0.4 |
| 1.6×0.6 |
故答案为:0.17;
②、由于CO与H2的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2的转化率,则增大H2的物质的量,即a/b的值小于1,
故答案为:小于1;
③、由①900℃时,该反应的平衡常数为0.17,实验4,在900℃时,在此容器中加入CO、H2O、CO2、H2均为1mol,则此时浓度商Qc=
| 1×1 |
| 1×1 |
故答案为:<;
(3))①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
依据盖斯定律①-②+③×4得:2CH3OH(l)+2O2(g)=2CO (g)+4H2O(l)△H=-885.6KJ/mol;
即CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
故答案为:CH3OH(l)+O2(g)=CO (g)+2H2O(l)△H=-442.8KJ/mol;
(4)向10mL 0.01mol?L-1 H2C2O4溶液中滴加10mL 0.01mol?L-1 NaOH溶液,二者恰好反应,所得溶液为NaHC2O4溶液,在该溶液中,直接电离出的Na+和HC2O4-浓度最大,NaHC2O4溶液显酸性,说明HC2O4-的电离程度大于水解,所以c(Na+)>c(HC2O4-),c(H+)>c(OH-),溶液中水电离生成氢离子,故c(H+)>c(C2O42-),溶液呈酸,电离产生的c(C2O42-)原大于c(OH-),溶液中离子浓度c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),
故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
(5)Na2CO3溶液的浓度为1×10-4mol/L,等体积混合后溶液中c(CO32-)=
| 1 |
| 2 |
| 2.8×10-9 |
| 5×10-5 |
故答案为:1.12×10-4.
点评:本题考查氧化还原反应配平、平衡常数的计算与运用、热化学方程式书写、离子浓度大小比较、溶度积的有关计算等,题目综合性较大,是对学生能力的考查,难度中等,(5)中计算为易错点,溶液忽略混合后溶液的浓度发生变化.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
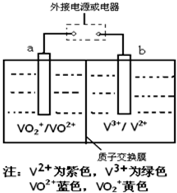 (2013?莱芜一模)某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )
(2013?莱芜一模)某充电电池的原理如图所示,溶液中c(H+)=2.0mol?L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色.下列对此电池叙述正确的是( )