题目内容
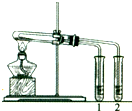
过氧化钠(Na2O2)是一种淡黄色固体.某化学兴趣小组的同学将包有Na2O2固体的棉花放入图甲烧杯中,缓慢倒入CO2后发现处于下面的蜡烛线熄灭,上面的后熄灭,同时也惊奇地发现棉花燃烧起来.

Ⅰ.实验中“下面的蜡烛线熄灭,上面的后熄灭”的现象说明二氧化碳具有______的性质.
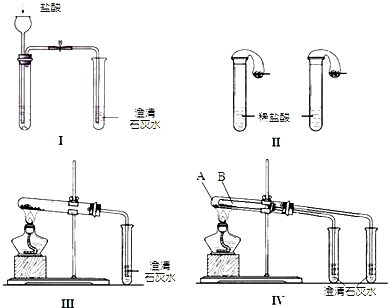
Ⅱ棉花为什么会燃烧呢?经过讨论后,该小组同学设计了如图乙的实验进行探究.
实验现象:
①一段时间后,在处放置一根带火星的小木条,小木条复燃;
②B中盛饱和的澄清石灰水的烧杯中出现白色不溶物.
分析并回答下列问题:
(1)A中发生反应的化学方程式为______;
(2)B中U形管内发生反应的化学方程式______;
(3)B装置的烧杯内出现白色不溶物的原因是______;
(4)“小木条复燃”说明Na2O2和CO2反应产生了______,“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应要______(填“吸收”或“放出”)热量,使棉花具备了燃烧条件.

Ⅰ.实验中“下面的蜡烛线熄灭,上面的后熄灭”的现象说明二氧化碳具有______的性质.
Ⅱ棉花为什么会燃烧呢?经过讨论后,该小组同学设计了如图乙的实验进行探究.
实验现象:
①一段时间后,在处放置一根带火星的小木条,小木条复燃;
②B中盛饱和的澄清石灰水的烧杯中出现白色不溶物.
分析并回答下列问题:
(1)A中发生反应的化学方程式为______;
(2)B中U形管内发生反应的化学方程式______;
(3)B装置的烧杯内出现白色不溶物的原因是______;
(4)“小木条复燃”说明Na2O2和CO2反应产生了______,“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应要______(填“吸收”或“放出”)热量,使棉花具备了燃烧条件.
Ⅰ、下面的蜡烛线熄灭,上面的后熄灭,说明二氧化碳比空气重,不燃烧也不支持燃烧,
故答案为:不燃烧且不支持燃烧,且密度比空气的密度大;
Ⅱ、(1)依据装置图和题干信息分析,A中是碳酸钠和硫酸的反应,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
故答案为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;
(2)在常温下Na2O2和CO2能发生化学反应,生成氧气,使带火星的木条复燃;并放出大量的热,溶液温度升高,氢氧化钙的溶解度减小,有固体析出,所以烧杯内的澄清石灰水变浑浊,B中U形管内为过氧化钠和二氧化碳的反应,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)在常温下Na2O2和CO2能发生化学反应,并放出大量的热,溶液温度升高,氢氧化钙的溶解度减小,有固体析出,所以烧杯内的澄清石灰水变浑浊,
故答案为:溶液温度升高,氢氧化钙的溶解度减小,有固体析出;
(4)“小木条复燃”说明过氧化钠和二氧化碳反应产生氧气;根据实验装置和实验现象可知:根据氢氧化钙的溶解度随温度的升高而降低,饱和的澄清石灰水变浑浊说明反应一定放出热量;所以反应放出热量,温度升高后,氢氧化钙的溶解度降低,析出固体,
故答案为:氧气;放热.
故答案为:不燃烧且不支持燃烧,且密度比空气的密度大;
Ⅱ、(1)依据装置图和题干信息分析,A中是碳酸钠和硫酸的反应,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,
故答案为:Na2CO3+H2SO4=Na2SO4+CO2↑+H2O;
(2)在常温下Na2O2和CO2能发生化学反应,生成氧气,使带火星的木条复燃;并放出大量的热,溶液温度升高,氢氧化钙的溶解度减小,有固体析出,所以烧杯内的澄清石灰水变浑浊,B中U形管内为过氧化钠和二氧化碳的反应,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)在常温下Na2O2和CO2能发生化学反应,并放出大量的热,溶液温度升高,氢氧化钙的溶解度减小,有固体析出,所以烧杯内的澄清石灰水变浑浊,
故答案为:溶液温度升高,氢氧化钙的溶解度减小,有固体析出;
(4)“小木条复燃”说明过氧化钠和二氧化碳反应产生氧气;根据实验装置和实验现象可知:根据氢氧化钙的溶解度随温度的升高而降低,饱和的澄清石灰水变浑浊说明反应一定放出热量;所以反应放出热量,温度升高后,氢氧化钙的溶解度降低,析出固体,
故答案为:氧气;放热.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目